朊病毒的传播受一个分层网络的控制,该网络涉及核内的Tfap2c和hnRNP K因子以及细胞质中的mTORC1复合体。
原标题:Prion propagation is controlled by a hierarchical network involving the nuclear Tfap2c and hnRNP K factors and the cytosolic mTORC1 complex
5 分
关键词
摘要
异质核核糖核蛋白K(hnRNP K)是朊病毒传播的限制因素。然而,除了它对细胞存活至关重要外,人们对hnRNP K的功能知之甚少。在此,我们进行了合成生存CRISPR消融筛选,以识别HNRNPK的表观遗传互作因子。我们发现,删除转录因子AP-2γ(TFAP2C)可以抑制hnRNP K耗竭的LN-229和U-251 MG细胞的死亡,而其过表达则使细胞对hnRNP K的缺失更加敏感。HNRNPK的消融降低了细胞ATP水平,下调了与脂质和葡萄糖代谢相关的基因,并增强了自噬。TFAP2C的共同删除逆转了这些效应,恢复了转录平衡并缓解了能量不足。我们将HNRNPK和TFAP2C的相互作用与mTOR信号传导联系起来,观察到HNRNPK的消融通过下调mTOR和Rptor抑制了mTORC1的活性,而TFAP2C的过表达增强了mTORC1的下游功能。在朊病毒感染的细胞中,TFAP2C的激活降低了朊病毒水平,并抵消了HNRNPK抑制导致的朊病毒传播增加。短期药理学抑制mTOR也提高了朊病毒水平,并部分模拟了HNRNPK沉默的效应。我们的研究确定了TFAP2C是HNRNPK的遗传互作因子,揭示了它们在mTOR代谢调节中的作用,并建立了这些活动与朊病毒传播之间的因果联系。
AI理解论文
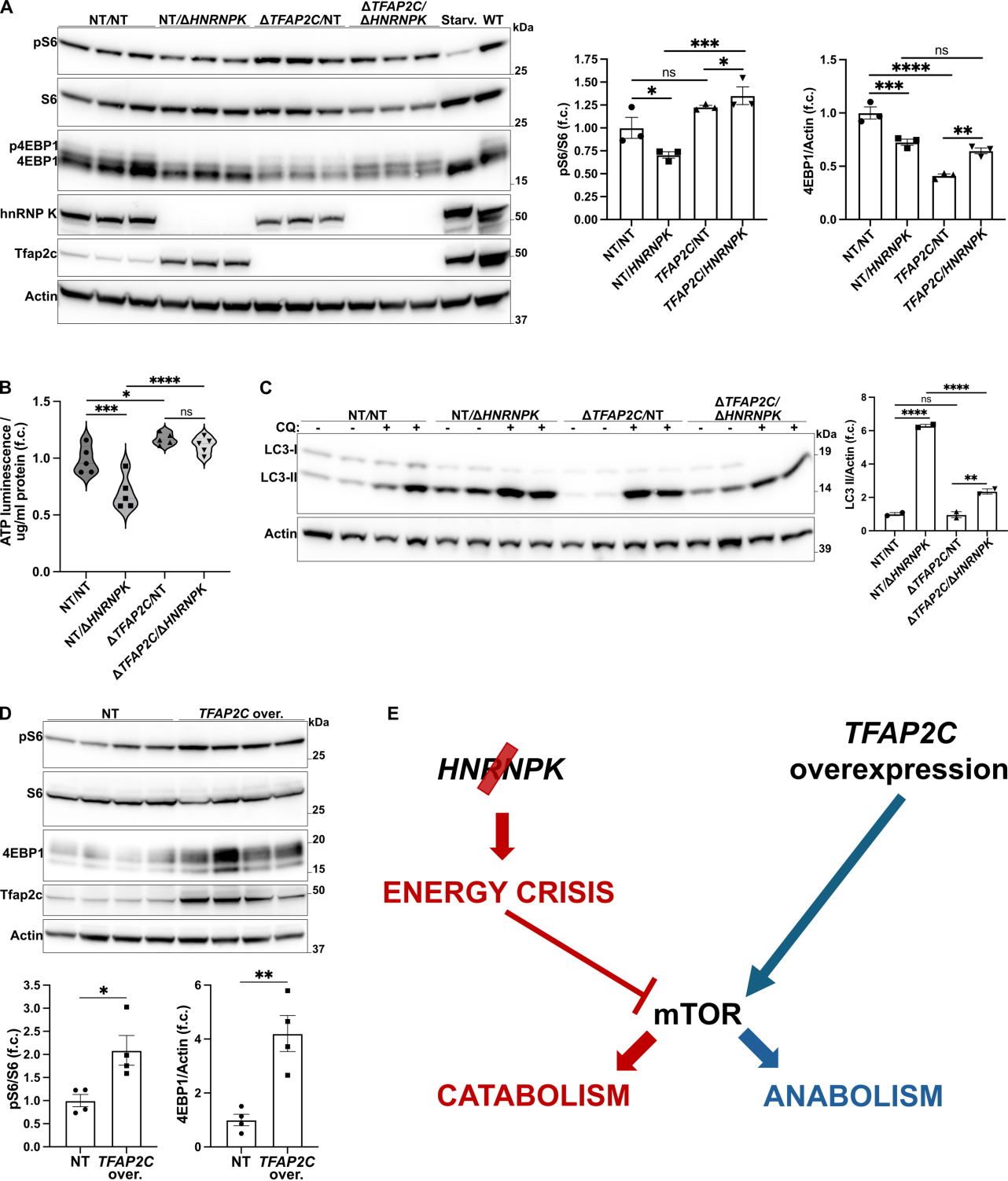
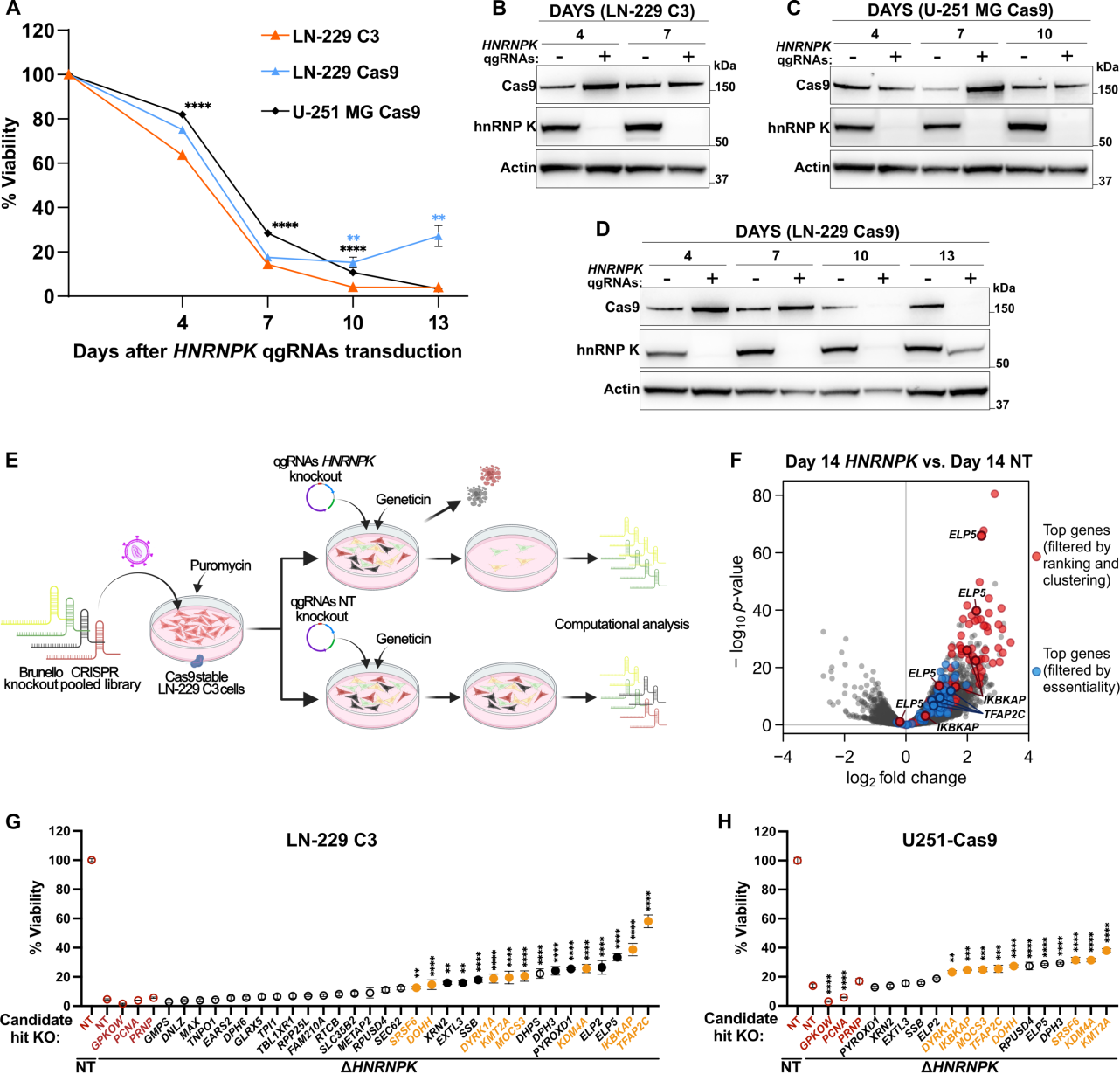
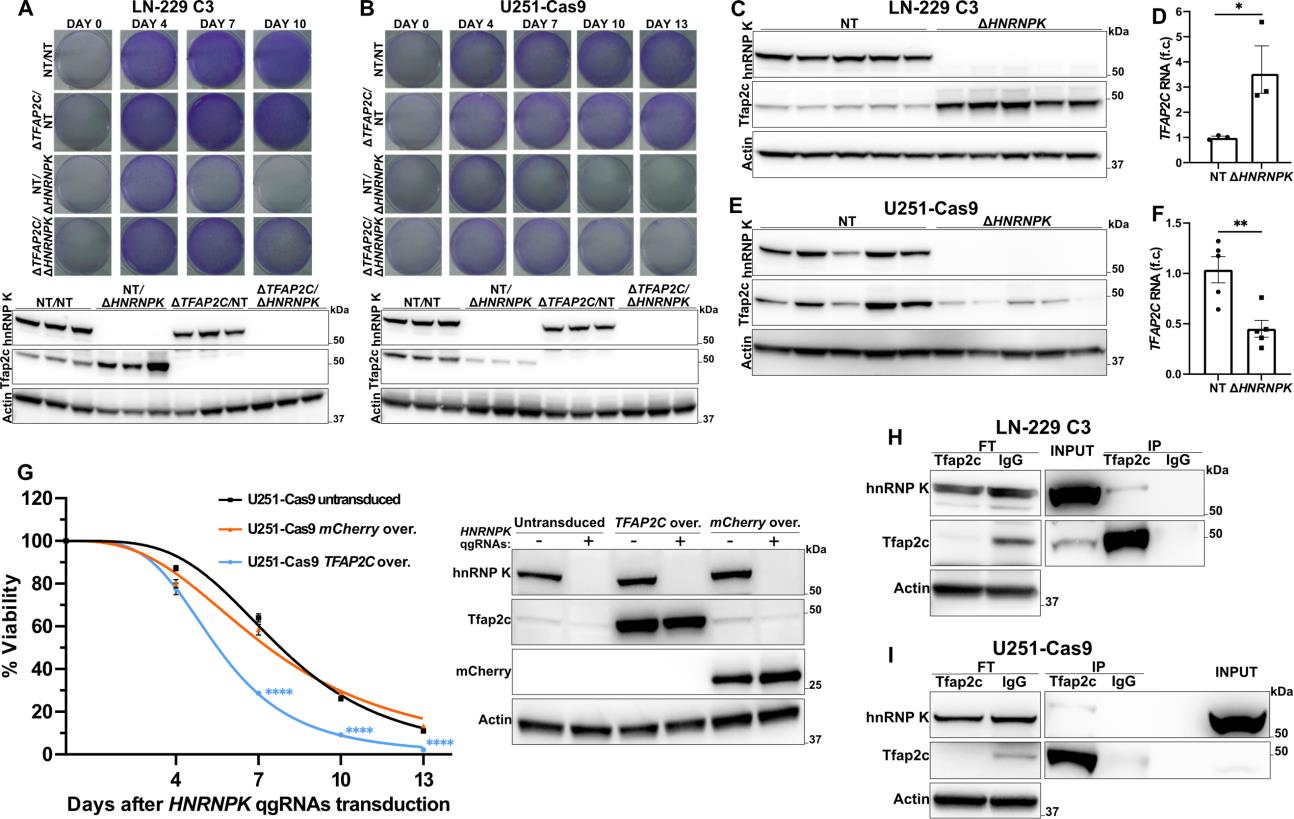
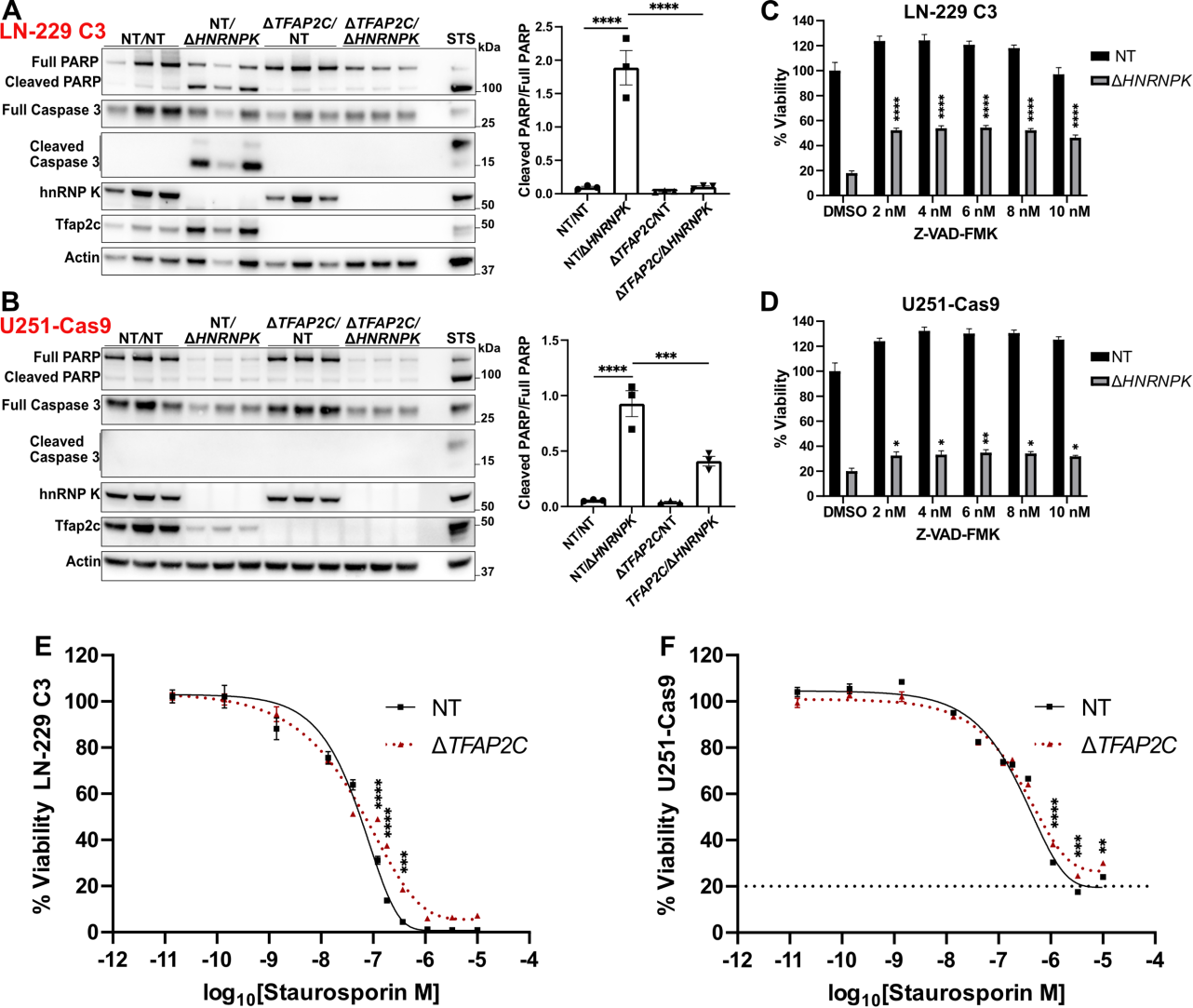
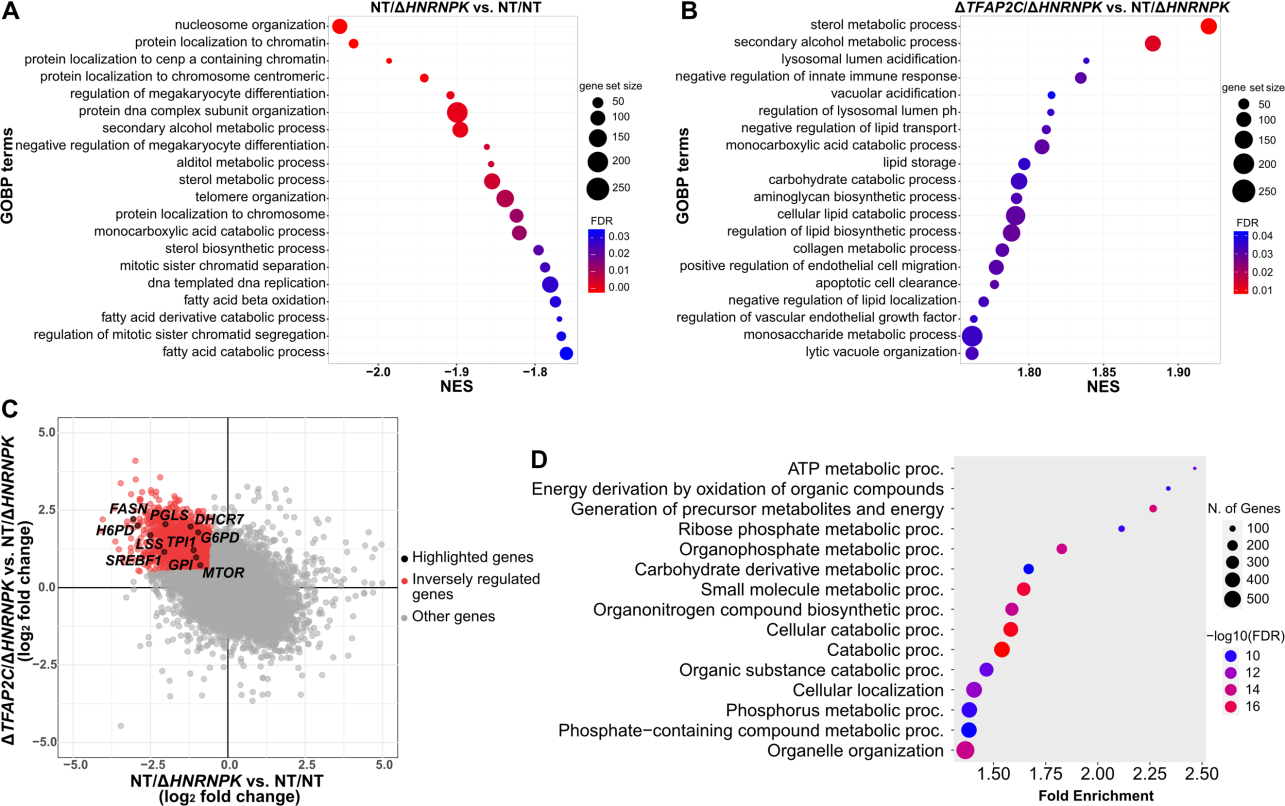


该文档是一篇科学研究论文,主要探讨了CRISPR-Cas9基因编辑技术在细胞模型中的应用,特别是针对HNRNPK基因的研究。以下是对该文档的详细总结:
研究背景与目的
该研究的主要目的是利用CRISPR-Cas9技术来研究HNRNPK基因在细胞中的功能。HNRNPK是一种核糖核蛋白,参与多种细胞过程,包括转录调控和RNA加工。研究人员希望通过基因敲除和激活实验,深入了解HNRNPK在细胞生存和基因表达中的作用。
方法与实验设计
-
CRISPR-Cas9基因编辑:研究使用了人类Brunello CRISPR消融文库,通过CRISPR-Cas9系统对LN-229细胞系进行基因编辑。文库中的sgRNA(单导向RNA)被设计用于靶向特定基因的敲除。
-
细胞模型的建立:研究中使用了LN-229和U-251MG细胞系,这些细胞系经过基因编辑后用于分析HNRNPK基因的功能。
-
数据分析:使用了多种生物信息学工具和软件包(如EdgeR和DESeq2)进行差异基因表达分析和基因富集分析。通过这些分析,研究人员能够识别出在基因敲除后上调或下调的基因。
-
实验技术:
- 流式细胞术:用于分析细胞中荧光标记的表达情况。
- 免疫荧光成像:用于观察细胞中蛋白质的定位和表达。
- RNA测序:用于分析基因敲除对全基因组表达的影响。
结果与发现
-
HNRNPK基因的功能:研究发现,HNRNPK基因的敲除会导致细胞生存能力的显著下降,表明该基因在细胞存活中起关键作用。
-
基因表达变化:通过RNA测序,研究识别出多个在HNRNPK敲除后显著上调或下调的基因。这些基因涉及多种细胞过程,包括转录调控、信号传导和细胞周期调控。
-
细胞模型的验证:通过流式细胞术和免疫荧光成像,研究验证了基因编辑的有效性和特异性。
讨论与结论
研究表明,HNRNPK在细胞生存和基因表达调控中具有重要作用。通过CRISPR-Cas9技术,研究人员能够有效地敲除该基因并观察其对细胞的影响。这为进一步研究HNRNPK在疾病中的作用提供了基础。
专业术语解释
- CRISPR-Cas9:一种基因编辑技术,利用Cas9核酸酶和sgRNA对特定DNA序列进行切割,从而实现基因的敲除或编辑。
- sgRNA:单导向RNA,用于引导Cas9核酸酶识别并切割特定的DNA序列。
- RNA测序:一种高通量测序技术,用于分析细胞中RNA的种类和丰度,从而了解基因表达的变化。
贡献与意义
该研究通过系统地分析HNRNPK基因的功能,揭示了其在细胞生存中的关键作用。这不仅为基础生物学研究提供了新的见解,也为相关疾病的治疗研究提供了潜在的靶点。研究中使用的CRISPR-Cas9技术展示了其在基因功能研究中的强大应用潜力。
总之,该文档详细描述了CRISPR-Cas9技术在基因功能研究中的应用,特别是针对HNRNPK基因的研究,为理解该基因在细胞生存中的作用提供了重要的科学依据。
