关于医疗器械上市后评估的真实世界证据(RWE)的系统文献综述。
原标题:A systematic literature review of real-world evidence (RWE) on post-market assessment of medical devices.
5 分
关键词
摘要
越来越多地使用真实世界证据(RWE)和真实世界数据(RWD)来评估上市后医疗器械(MDs),可能满足数据共享和可追溯性的紧迫需求。本研究旨在:(i)概述当前在MDs上市后评估中报告RWE/RWD的实践;(ii)为政府和卫生组织制定政策建议,并为学者确定研究议程。根据PRISMA指南,进行了一项系统综述,截止到2024年2月。纳入了英文的原始同行评审文章,这些文章将RWE/RWD纳入任何形式的MD上市后评估策略,并手动检查其参考文献列表。采用叙述性综合方法描述所获取的证据。共识别出145篇研究文章。主要利用行政数据库;在短期/中期时间范围内收集的临床和/或经济证据是最常报告的;其他证据类型(如组织性)报告不足;很少纳入患者观点;MDs的创新复杂性相对较低。据我们所知,本研究是首个全面展示在真实生活条件下评估MDs时如何使用非随机证据的研究。此综述的影响可能有助于卫生政策学者在RWE的研究方向上为MDs提供指导,并帮助政策制定者更好地理解MDs在中长期使用中的风险和收益,从而在采纳和使用方面做出更明智的决策。
AI理解论文


这篇论文主要探讨了**真实世界证据(RWE)和真实世界数据(RWD)**在医疗器械(MD)上市后评估中的应用。研究通过系统综述(SR)的方法,分析了相关文献,以揭示近年来科学界对使用RWE/RWD评估新型或创新医疗器械上市后性能的兴趣增长趋势。
研究背景与目的
论文的背景是医疗器械在上市后需要进行性能评估,以确保其在真实世界条件下的安全性和有效性。传统的随机对照试验(RCT)虽然是评估医疗干预措施的金标准,但在实际应用中存在局限性。因此,研究者们越来越关注RWE/RWD的使用,这些数据是在传统RCT环境之外收集的,能够更好地反映真实世界的使用情况。
方法
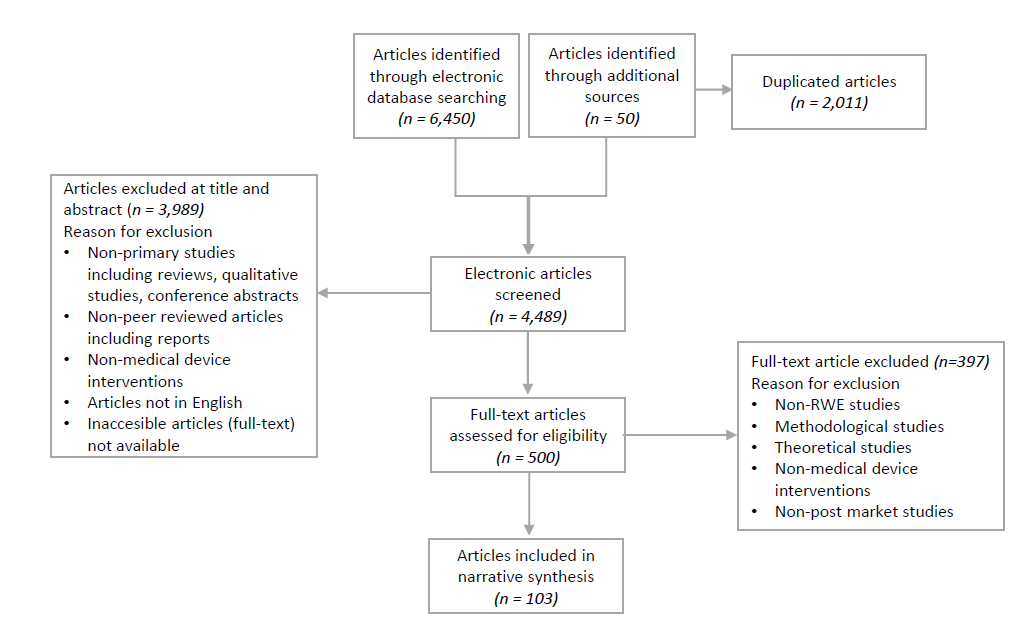
研究遵循系统综述和Meta分析的首选报告项目(PRISMA)指南,以减少偏倚和错误的风险。研究使用了质量评估检查表(QAC)和简化版的健康经济学评价报告标准(CHEERS)指南来提取和评估研究质量和经济证据。研究的文献搜索识别了6500个结果,经过筛选后,最终纳入了103篇主要研究文章。
结果
-
研究类型与方法:在纳入的103篇文章中,定量方法是最常用的(82%),而混合方法和定性方法分别占11%和7%。仅有少数定量研究报告了决策分析模型及其敏感性分析。
-
研究建议:大多数研究(64%)对在临床实践中使用或继续使用医疗器械给出了明确的正面建议。10%的研究报告了负面结果,建议停止使用该设备。
-
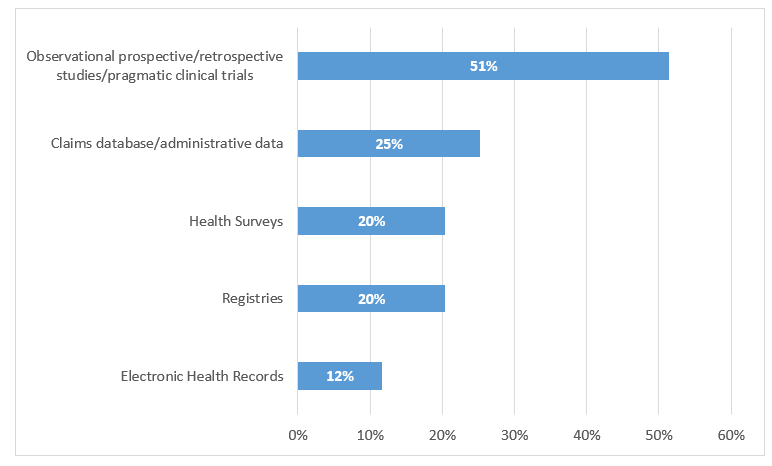
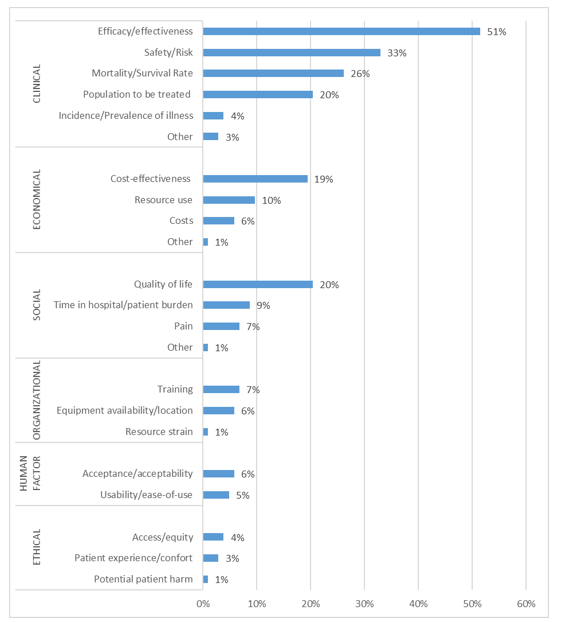
研究特征:研究中使用的RWE/RWD被分类为临床、经济、社会、组织、人因和伦理等类型,其中临床证据最为常见(85%)。观察性前瞻性/回顾性研究是最常见的RWE/RWD来源(51%)。
-
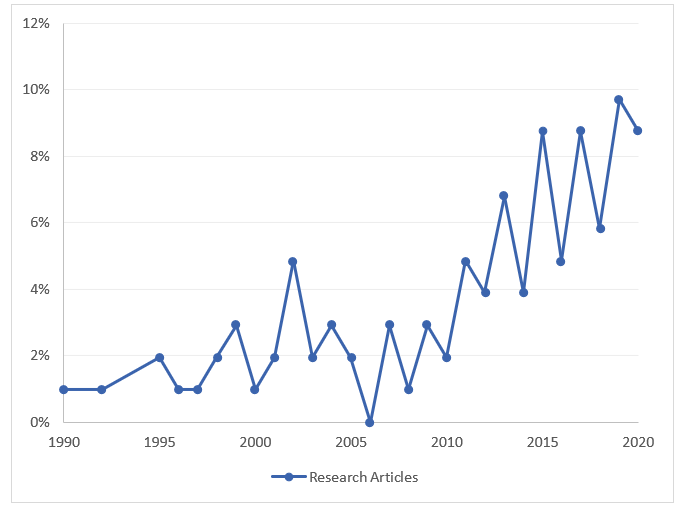
时间趋势与数据来源:从2010年到2020年,使用RWE/RWD的研究数量逐渐增加,尤其是使用索赔/行政数据库的研究数量增加了三倍。
-
研究的时间跨度与聚合水平:研究的时间跨度分为小于1年、1到5年和大于5年。大多数研究在国家或医院层面进行数据聚合。
-
医疗器械类型与临床专科:研究评估的医疗器械主要是治疗性设备(60%),其次是诊断设备(20%)。心血管是最常见的临床专科(40%)。
讨论与贡献
论文强调了RWE/RWD在医疗器械上市后评估中的重要性,尤其是在真实世界条件下的应用。研究揭示了近年来科学界对使用RWE/RWD评估新型或创新医疗器械上市后性能的兴趣增长趋势,并指出了不同类型的证据在评估中的应用情况。
结论
研究表明,RWE/RWD在医疗器械上市后评估中具有重要价值,能够提供更全面的证据支持决策。未来的研究应继续探索如何更有效地整合RWE/RWD,以提高医疗器械评估的质量和可靠性。
通过这篇论文,读者可以全面了解RWE/RWD在医疗器械上市后评估中的应用现状、方法和趋势,为进一步研究和实践提供了重要的参考。
