以激酶组为重点的CRISPR-Cas9筛选在非洲血统患者来源的乳腺癌类器官中识别出关键激酶以及EGFR和FGFR1抑制的协同作用。
原标题:Kinome-Focused CRISPR-Cas9 Screens in African Ancestry Patient-Derived Breast Cancer Organoids Identify Essential Kinases and Synergy of EGFR and FGFR1 Inhibition.
5 分
关键词
摘要
精准医学的癌症治疗方法旨在利用个体患者特有的基因组改变来定制治疗策略。然而,即使在没有直接基因组改变的情况下,一些可靶向的基因和通路对于肿瘤细胞的生存也是至关重要的。在代表性不足的人群中,由于在临床试验和研究中的参与有限,其突变景观和对现有疗法的反应决定因素尚未得到充分表征。揭示肿瘤必需基因的一种方法是通过基因筛选。大多数筛选是在经过多年非生理条件培养的细胞系上进行的,这些细胞系与患者肿瘤几乎没有相似之处。为了解决这个问题,我们旨在开发一种在三维生长的患者来源肿瘤类器官(PDTO)模型中进行CRISPR筛选的流程。建立了一个专注于代表性不足人群的乳腺癌PDTO生物库,包括西非患者,并使用该生物库进行负选择激酶组聚焦的CRISPR筛选,以识别对类器官生长至关重要的激酶以及与EGFR或MEK抑制剂联合治疗的潜在靶点。筛选识别出几个先前未识别的激酶靶点,并且FGFR1和EGFR抑制剂的组合协同阻止了类器官的增殖。总体而言,这些数据证明了在患者来源肿瘤模型中进行CRISPR基因筛选的可行性,包括来自代表性不足癌症患者的PDTO,并识别出癌症治疗的靶点。意义:生成一个专注于代表性不足人群的乳腺癌患者来源肿瘤类器官生物库,使得激酶组聚焦的CRISPR筛选成为可能,识别出必需的激酶和与EGFR或MEK抑制剂联合治疗的潜在靶点。参见Trembath和Spanheimer的相关评论,第407页。
AI理解论文




该文档主要探讨了精准医学在癌症治疗中的应用,特别是通过CRISPR筛选技术在患者来源的肿瘤类器官(PDTO)模型中识别潜在的治疗靶点。研究的重点是开发一种在三维培养的PDTO模型中进行CRISPR筛选的流程,以识别可能转化为靶向治疗选择的必需激酶,包括组合疗法。
研究背景与目的
精准肿瘤学的核心理念是通过识别患者肿瘤中的基因变异,并使用与这些变异相匹配的药物进行靶向治疗。然而,研究表明,即使存在可操作的变异,许多患者仍未能从中受益,因为恶性过程可能由非遗传机制驱动。因此,功能性精准医学作为一种补充策略,通过创建个体肿瘤的体外模型并直接暴露于药物中,来连接基因型和表型。
方法
-
PDTO的建立:研究建立了一个以代表性不足人群为重点的乳腺癌PDTO生物库,包括来自西非患者的样本。PDTO的建立过程包括从新鲜乳腺切除样本中提取组织,进行机械和酶解消化,然后在特定培养基中培养。
-
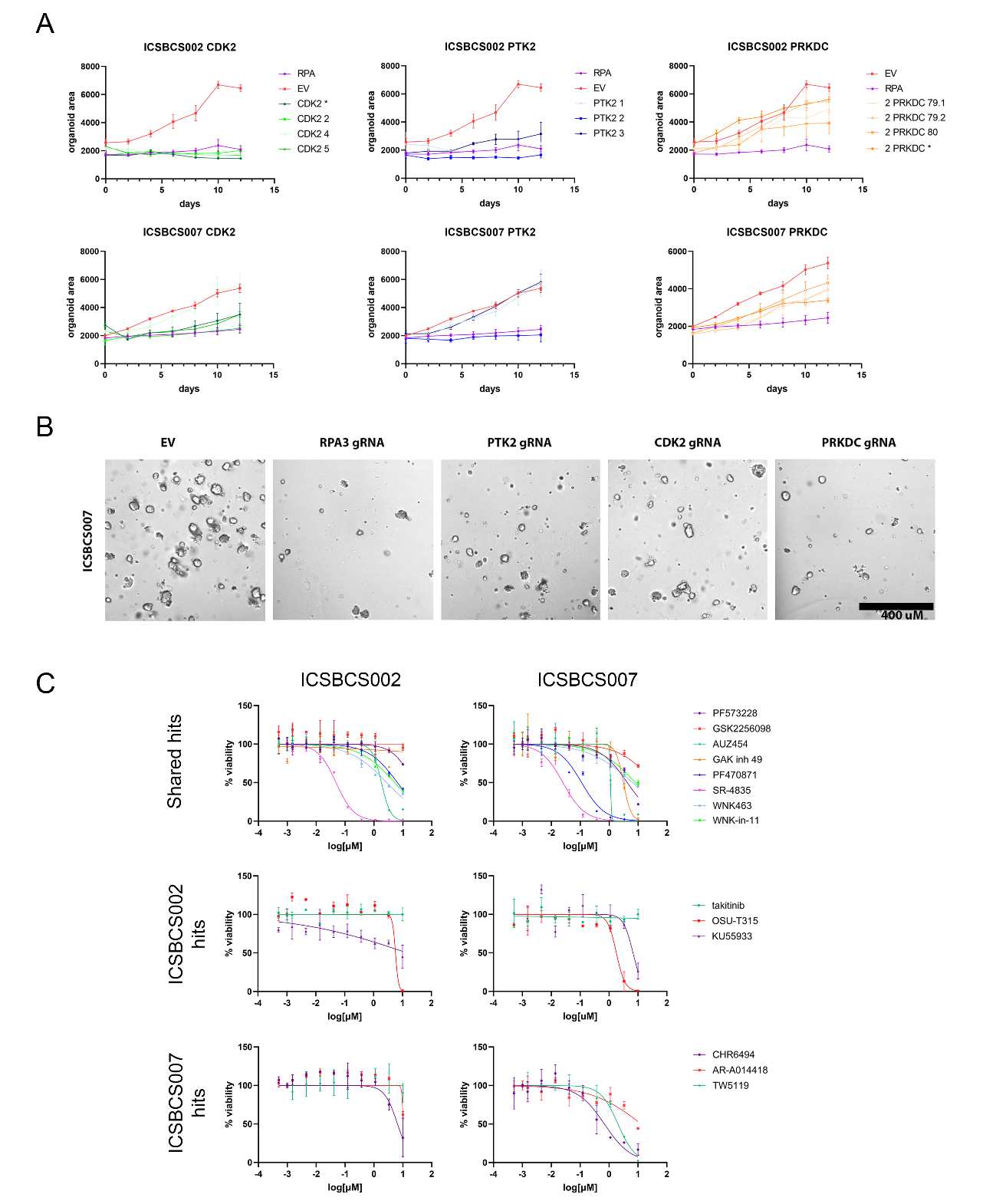
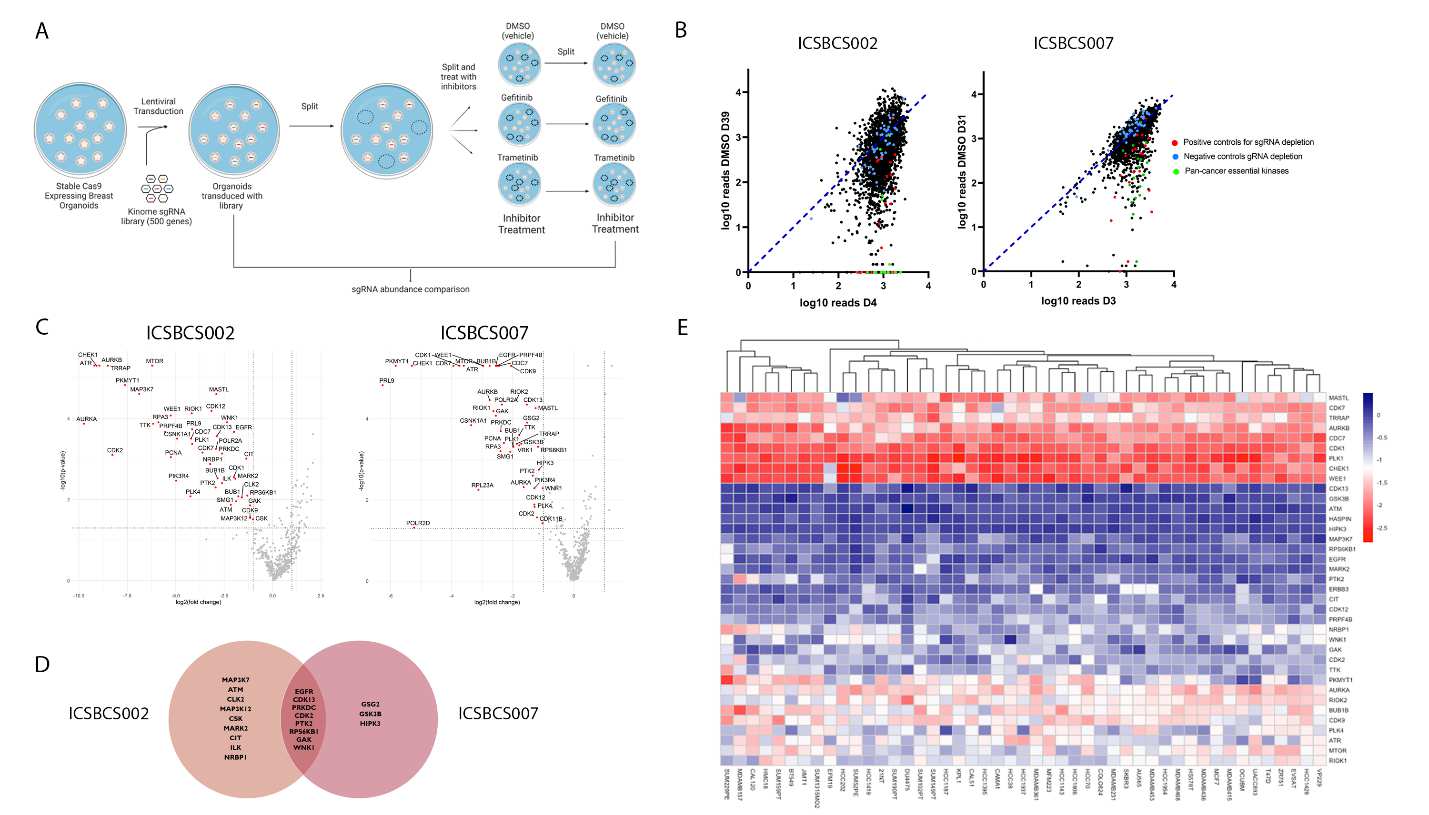
CRISPR筛选:使用负选择激酶聚焦CRISPR筛选来识别对类器官生长至关重要的激酶。筛选使用了一个人类激酶域聚焦的gRNA库,通过稳定表达Cas9的PDTO系进行转导,以评估CRISPR筛选作为识别新型脆弱性的工具。
-
药物测试:研究测试了多种药物,包括EGFR和MEK抑制剂,以评估其与新识别的激酶靶点的组合效果。
结果
-
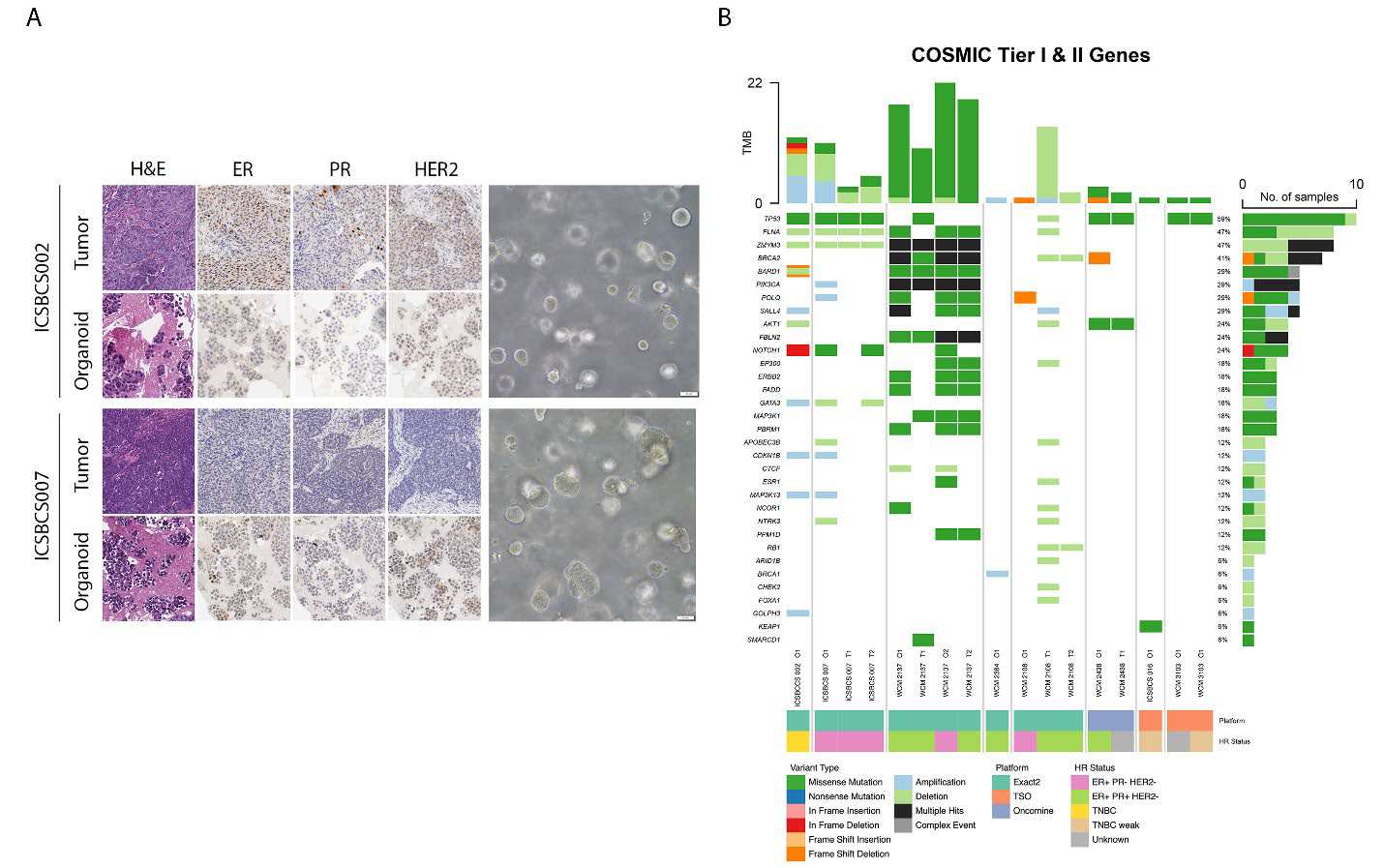
PDTO模型的建立与验证:研究成功建立了多个PDTO模型,并通过组织病理学和免疫组化验证了这些模型与原始肿瘤的形态和分子特征的一致性。
-
基因表达与突变分析:通过RNA测序和PAM50基因表达面板对PDTO进行亚型分类,发现这些模型在基因表达和突变谱上与原始肿瘤高度一致。
-
CRISPR筛选结果:筛选识别出多个先前未识别的激酶靶点,并证明FGFR1和EGFR抑制剂的组合能够协同阻止类器官增殖。
贡献与意义
该研究展示了在PDTO模型中进行CRISPR筛选的可行性,特别是在代表性不足的癌症患者中。这种方法不仅有助于识别新的癌症治疗靶点,还为功能性精准医学提供了一个强有力的工具,以补充传统的基因组测试。
术语解释
- 精准医学:一种根据个体的基因、环境和生活方式量身定制的疾病治疗和预防方法。
- CRISPR筛选:一种基于CRISPR-Cas9技术的高通量基因编辑方法,用于识别基因功能。
- 患者来源的肿瘤类器官(PDTO):从患者肿瘤组织中提取并在体外培养的三维细胞模型,保留了原始肿瘤的特征。
- 负选择筛选:一种筛选方法,通过去除对生存至关重要的基因来识别必需基因。
总结
该研究通过结合CRISPR筛选和PDTO模型,提供了一种新的方法来识别癌症治疗的新靶点,特别是在代表性不足的人群中。这种方法不仅增强了对肿瘤生物学的理解,还为开发个性化治疗策略提供了新的视角。
