插入缺失驱动鸟氨酸tRNA编辑去乙酰化酶CtdA的进化
原标题:Indel-driven evolution of the canavanine tRNA-editing deacetylase enzyme CtdA
5 分
关键词
摘要
蛋白质是由二十种标准氨基酸组成的多聚异体。然而,自然界中存在超过500种非蛋白源性氨基酸,它们可能被错误地整合到蛋白质中。骆驼尼斯是一种L-精氨酸的抗代谢物,具有高度的化学相似性。某些细菌,如豆科植物根瘤菌中的假单胞菌canavaninivorans,可以将其作为唯一的碳和氮来源。然而,这种细菌的蛋白质中也会包含骆驼尼斯,因为它的精氨酰-tRNA合成酶会同时将骆驼尼斯和精氨酸加载到tRNAArg上。最近发现的骆驼酰基-tRNAArg脱乙酰酶(CtdA)能够去除误加载到tRNAArg上的骆驼尼斯,从而防止其被整合到蛋白质中。CtdA是已知的第一个能够编辑误加载非蛋白源性氨基酸的tRNA的酶。我们已经解析了其晶体结构至1.5Å的分辨率,并使用定点突变分析研究了其活性位点。我们发现CtdA是一个小的单体酶,具有一个中心深腔,预测这构成了骆驼尼斯的结合位点,还有一个带正电荷的表面区域,可能协调CCA-3’tRNA附着序列。独立的、转编辑的CtdA与大多亚基苯丙氨酸tRNA合成酶(PheRS)的B3/B4顺编辑域有远亲关系。我们的比较研究揭示,来自细菌和古菌/真核的CdtA和B3/B4域是同一保守3D折叠的三个亚类,它们在特定插入缺失中有所不同,从而明显地塑造了这些蛋白质的底物结合裂隙。我们提出这个3D折叠的次级结构元素的统一命名。在CtdA中,E191、Y104、N105和E118对催化起到关键作用,其中N105在细菌的B3/B4域中是保守的。在这个酶类中,未能识别出其他具有催化重要性的共有残基,因此这些编辑酶中共享的催化机制似乎不太可能。
AI理解论文
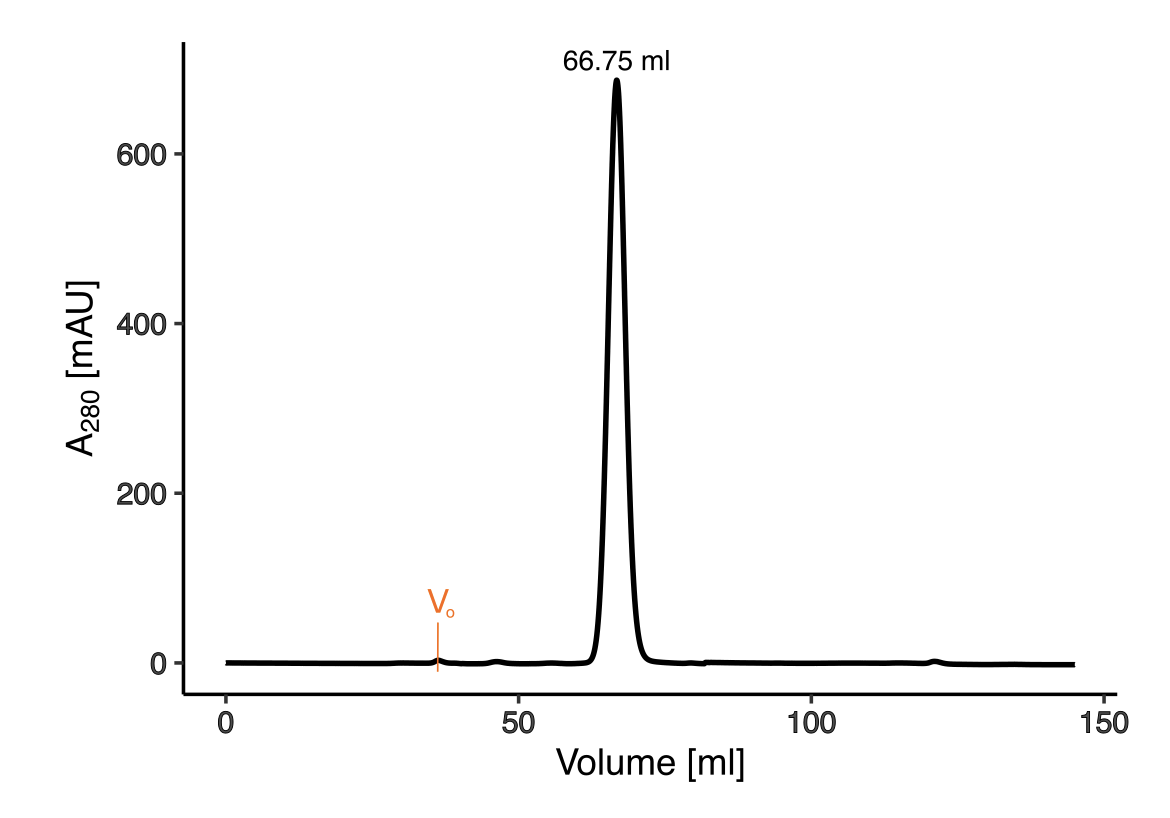
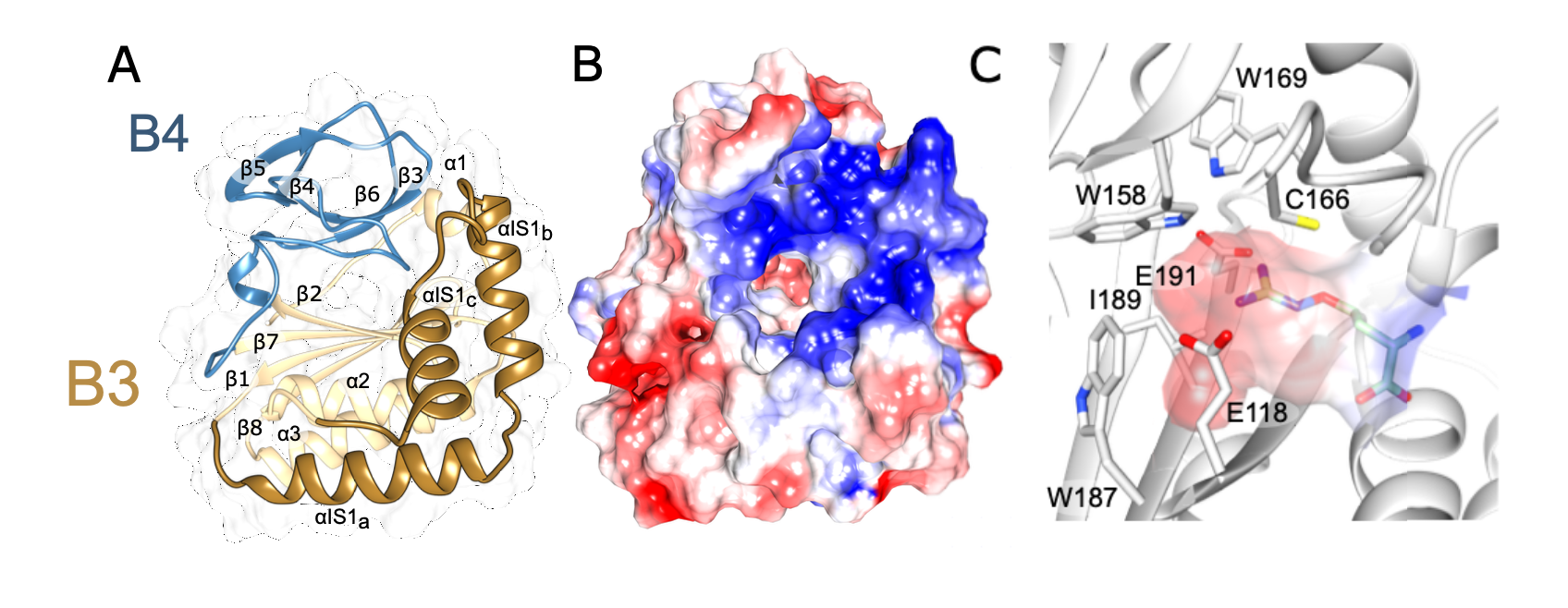
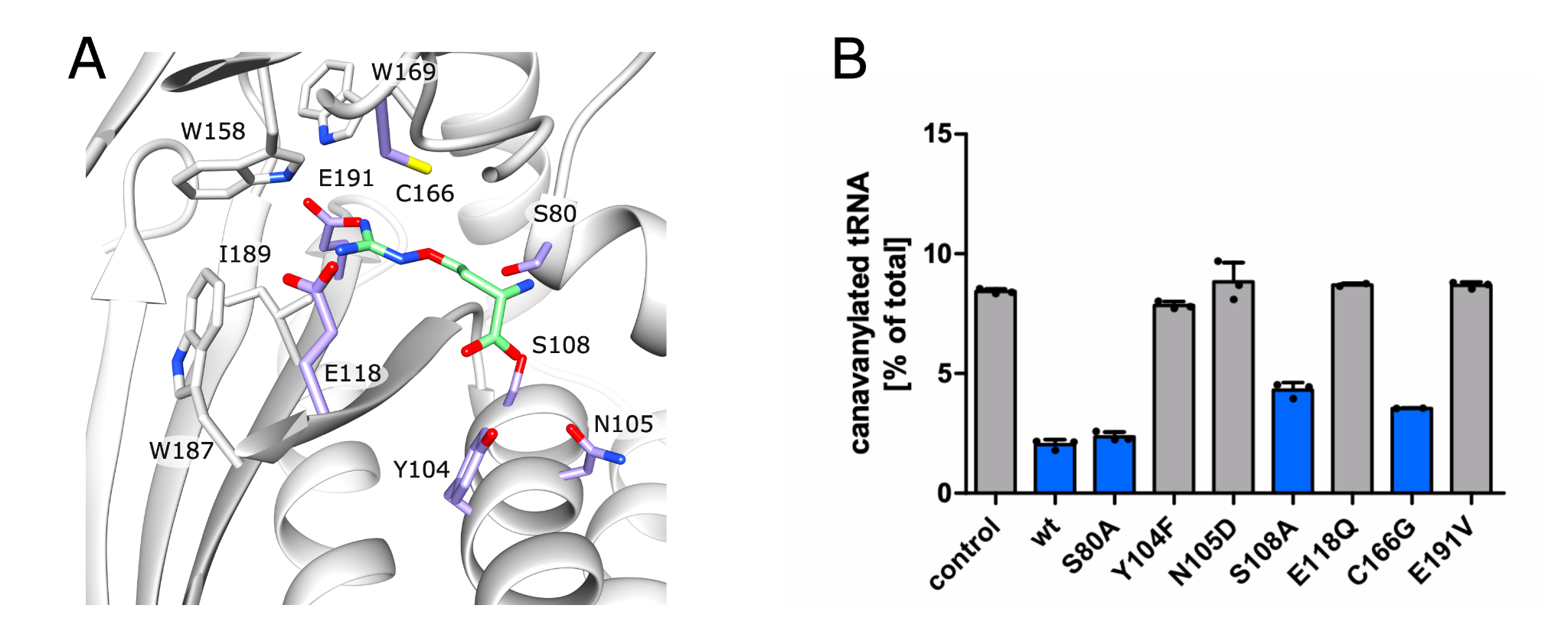
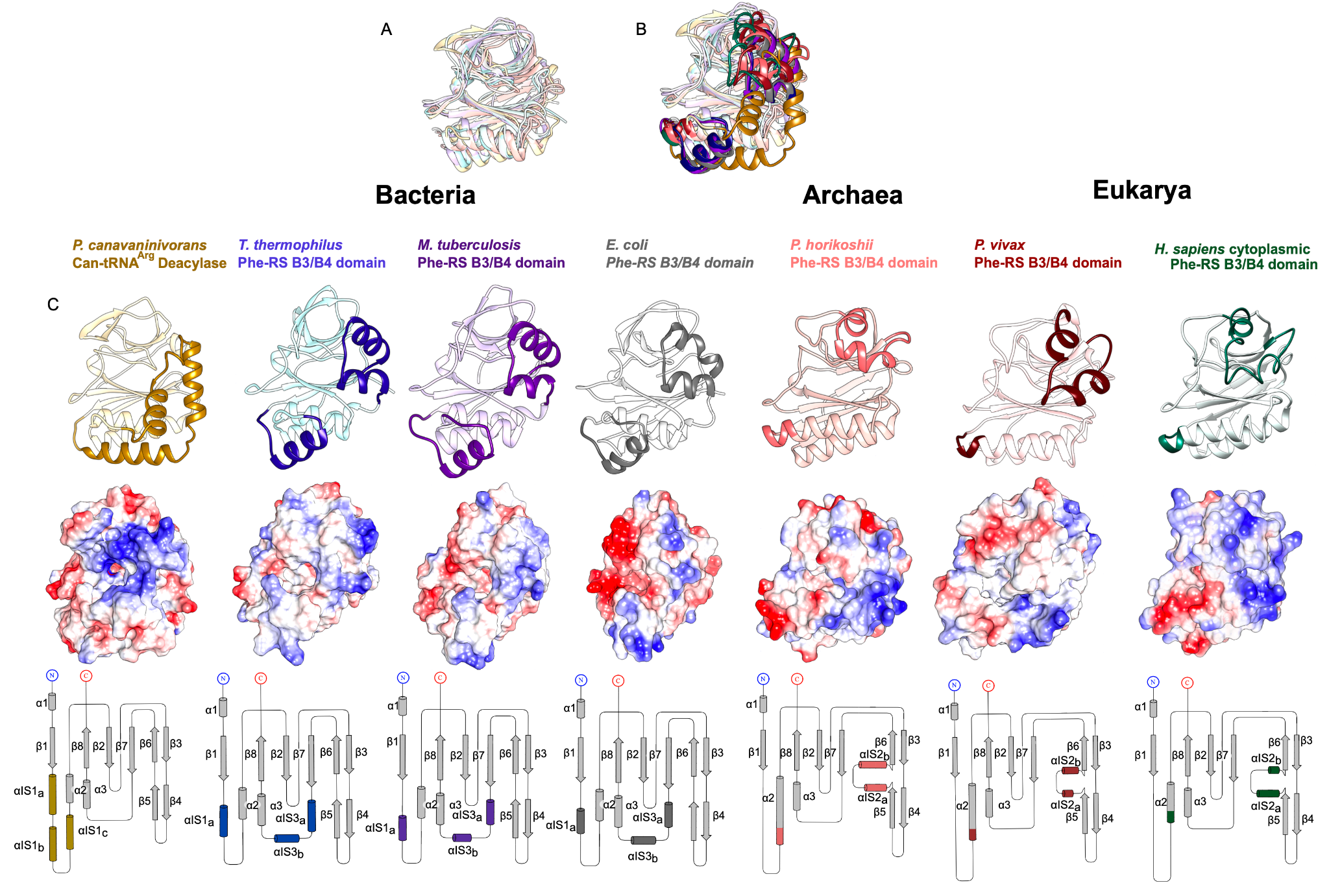



该文档主要探讨了CtdA(canavanyl-tRNAArg deacetylase)的特性及其在蛋白质翻译质量控制中的作用。CtdA是首个被鉴定为作用于非蛋白质基质的独立转编辑酶,与PheRS(phenylalanyl-tRNA synthetase)酶的B3/B4结构域有同源性。以下是该文档的主要内容:
研究背景
蛋白质翻译的准确性对于细胞功能至关重要。氨酰-tRNA合成酶(aaRSs)负责将正确的氨基酸连接到相应的tRNA上。然而,aaRSs有时会错误地加载结构相似的非同源氨基酸。为了纠正这些错误,细胞利用编辑机制,包括顺式编辑(cis-editing)和反式编辑(trans-editing)。顺式编辑发生在aaRSs的编辑活性位点,而反式编辑则由独立的编辑酶完成。
CtdA的发现与特性
CtdA是一个独立的转编辑酶,能够去除非蛋白质氨基酸canavanine(一种类似于精氨酸的抗代谢物)从tRNAArg上。canavanine与精氨酸仅在侧链的一个原子上有所不同(δ-氧代替δ-碳)。CtdA的发现表明其在细菌中起到避免canavanine中毒的作用,这种中毒通常由canavanine错误地代替精氨酸整合到蛋白质中引起。
结构分析
通过晶体结构解析,研究揭示了CtdA与PheRS的B3/B4结构域在三维折叠上的相似性,尽管序列保守性较低。CtdA和B3/B4结构域之间的相似性体现在一个形成氨酰基结合位点的腔体上,该腔体的入口由α-发夹结构形成。CtdA的α-发夹结构包含17个正电荷残基,可能有助于tRNA干茎的结合和识别。
实验方法
研究中,tRNAArg通过体外转录获得,并通过PAGE纯化。随后,使用α-32P-ATP标记tRNA,并进行氨酰化反应。反应混合物中包含ArgRS酶和底物(精氨酸或canavanine)。氨酰化后的tRNA与CtdA蛋白孵育,随后通过薄层色谱分析反应产物。
研究贡献
该研究首次揭示了CtdA作为独立转编辑酶的功能,尤其是其在处理非蛋白质基质方面的独特性。CtdA的发现拓展了我们对转编辑酶的理解,尤其是在细菌如何通过编辑机制避免非蛋白质氨基酸中毒方面。此外,CtdA与PheRS的结构相似性为研究其他潜在的转编辑酶提供了新的视角。
结论
CtdA的研究不仅揭示了其在细菌适应环境压力中的重要作用,还为理解蛋白质翻译质量控制提供了新的见解。通过对CtdA的结构和功能的深入研究,科学家们可以更好地理解细胞如何通过复杂的编辑机制维持蛋白质合成的准确性。
术语解释
- 氨酰-tRNA合成酶(aaRSs):一种酶,负责将氨基酸连接到相应的tRNA上。
- 顺式编辑(cis-editing):在aaRSs的编辑活性位点进行的错误校正。
- 反式编辑(trans-editing):由独立的编辑酶进行的错误校正。
- 晶体结构解析:一种用于确定分子三维结构的技术。
- 薄层色谱:一种用于分离和分析化合物的技术。
通过对CtdA的研究,本文为理解细胞如何通过编辑机制维持蛋白质合成的准确性提供了新的视角,并揭示了细菌在面对环境压力时的适应策略。
