通过骆驼单域抗体对锥虫类丙酮酸激酶的变构抑制
原标题:Allosteric inhibition of trypanosomatid pyruvate kinases by a camelid single-domain antibody
5 分
关键词
摘要
非洲锥虫是被忽视的热带病的致病因子,影响着人类和牲畜。由于药物治疗失败的案例不断增加,疾病控制变得极具挑战性。非洲锥虫是血液传播的细胞外寄生虫,主要依赖糖酵解来进行其在哺乳动物宿主内的能量代谢。因此,锥虫的糖酵解酶成为开发抗锥虫药物的研究兴趣所在。在此,我们报告了一个偶然发现的骆驼单域抗体(sdAb,也称为纳米抗体),它通过变构机制选择性地抑制锥虫(但不抑制宿主)丙酮酸激酶的酶活性。通过结合酶动力学、生物物理学、结构生物学和转基因寄生虫存活实验,我们提供了一个概念验证,证明sdAb介导的酶抑制对寄生虫的适应性和生长产生负面影响。
AI理解论文
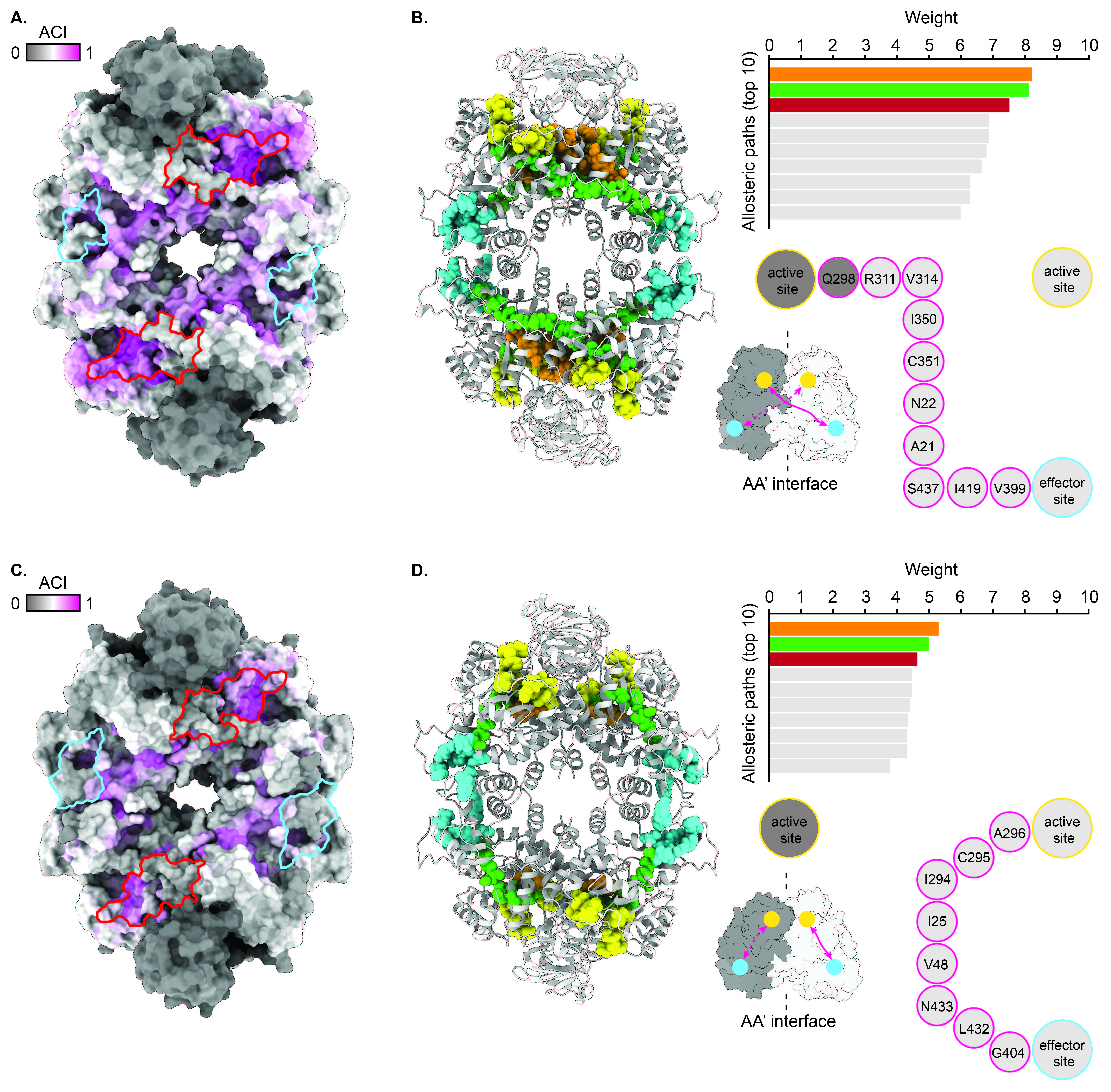


这篇论文主要探讨了抗体及其片段在药物发现中的潜力,特别是单域抗体(sdAbs)在识别和稳定动态抗原特定构象方面的能力。研究的重点是利用单域抗体sdAb42识别和抑制锥虫类寄生虫的丙酮酸激酶(PYK),为设计新型化疗药物提供了可能性。
研究背景与目的
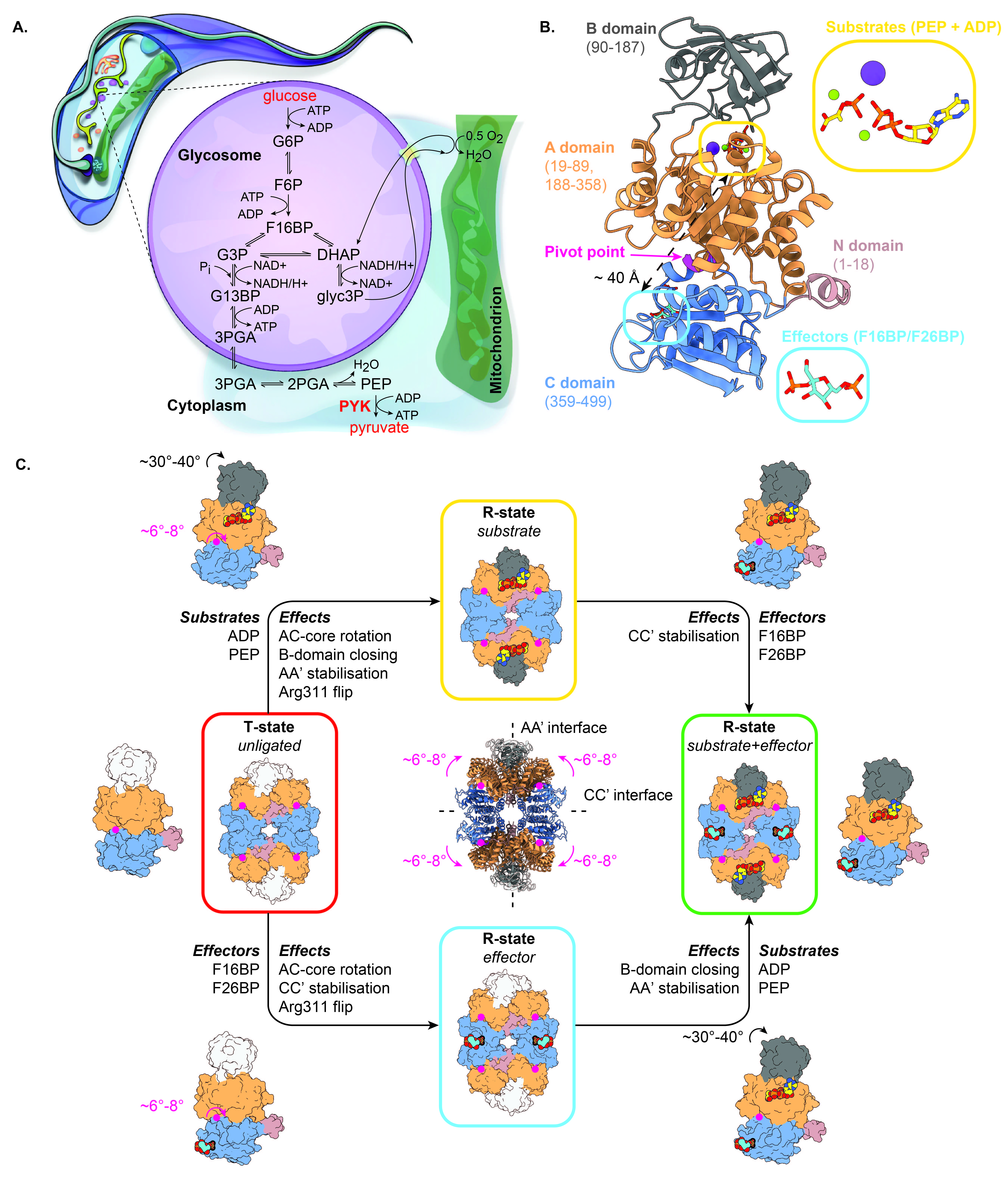
锥虫类寄生虫(Trypanosomatids)是引发多种热带疾病的病原体,其代谢途径中的关键酶如丙酮酸激酶(PYK)是潜在的药物靶点。丙酮酸激酶催化糖酵解的最后一步,是寄生虫能量代谢的关键节点。研究的目的是通过识别PYK的脆弱位点,开发针对锥虫类寄生虫的特异性抑制剂。
方法与材料
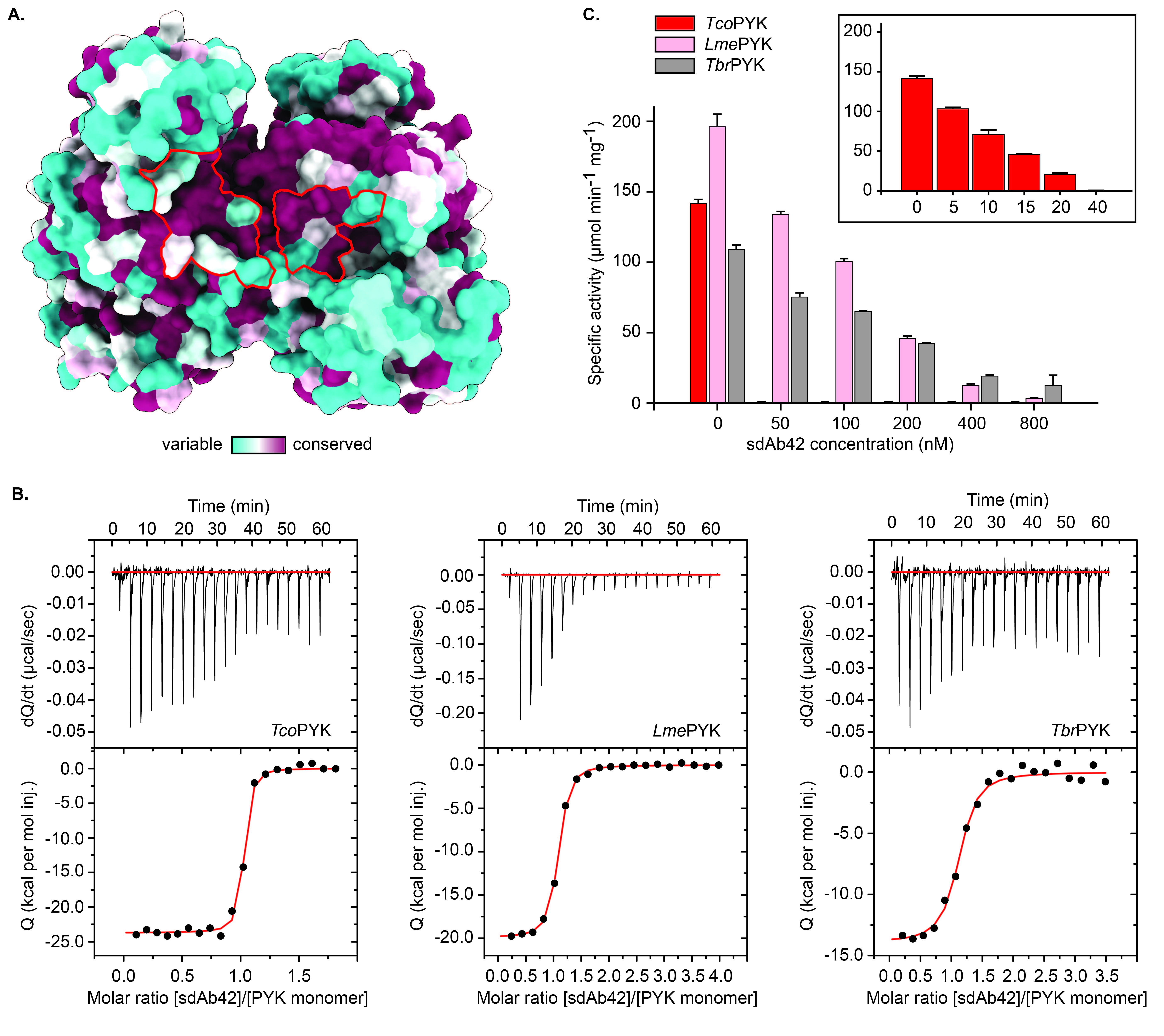
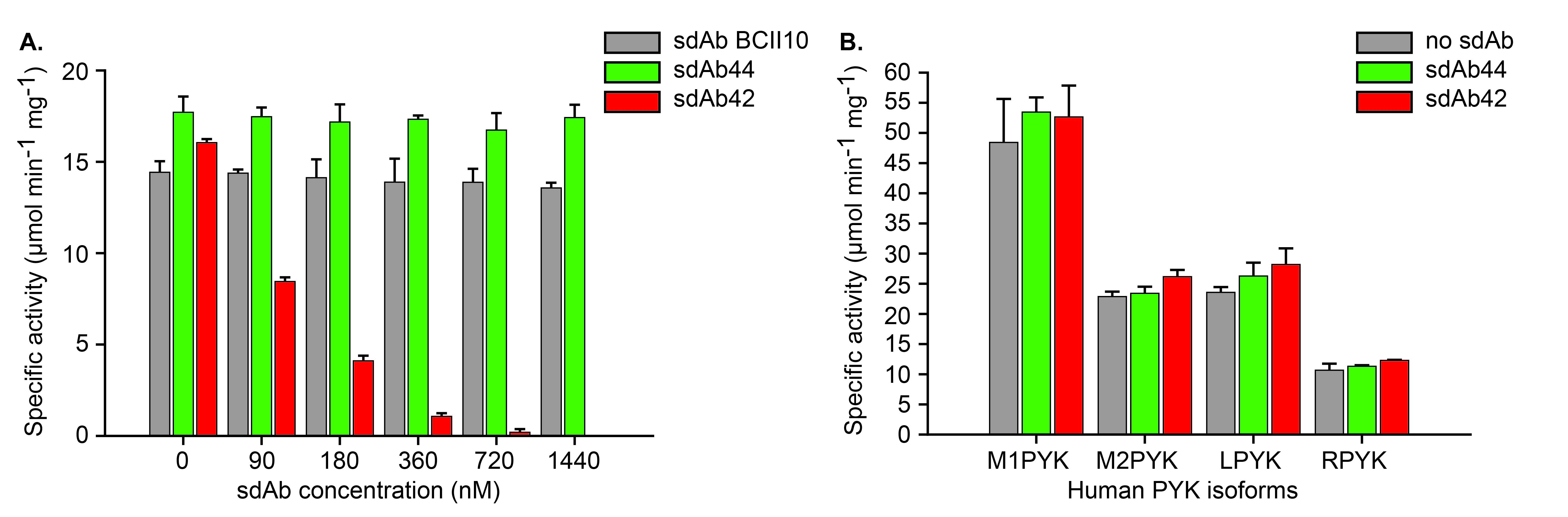
研究中使用了克隆、重组蛋白生产和纯化技术,获得了来自不同锥虫类寄生虫的PYK,包括T. brucei和L. mexicana。研究还使用了两种单域抗体sdAb42和sdAb44,通过酶促反应和酶动力学实验评估其对TcoPYK的抑制作用。实验采用了乳酸脱氢酶(LDH)偶联测定法,以监测酶活性变化。
结果与讨论
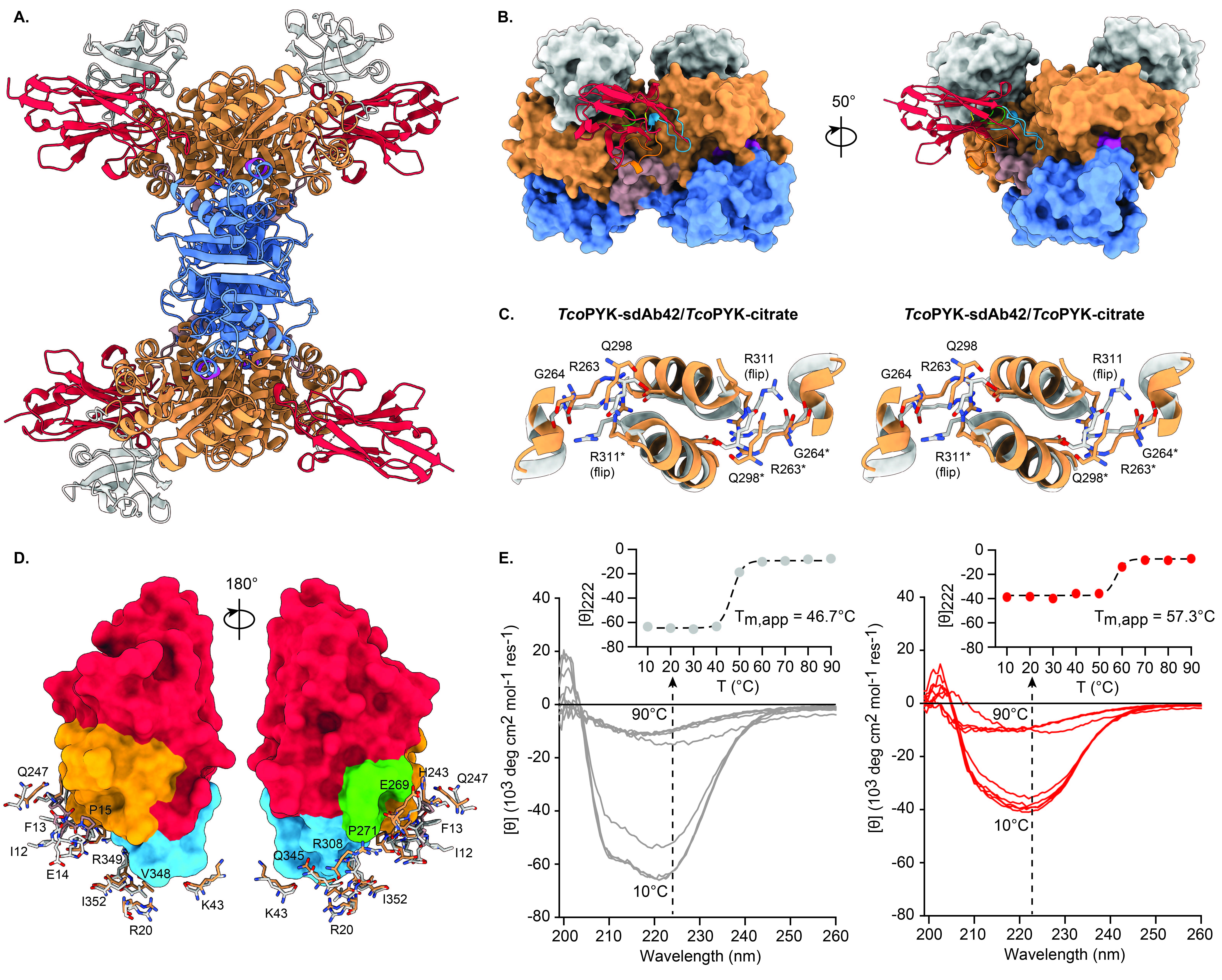
研究发现,sdAb42能够选择性地抑制TcoPYK的活性,而对人类PYK同工酶无显著抑制作用。这表明sdAb42具有高度的特异性,能够识别并结合TcoPYK的特定构象。通过晶体学分析,研究揭示了sdAb42与TcoPYK结合的结构基础,显示出sdAb42结合在PYK的一个关键区域,可能影响其构象变化和催化活性。
结构分析
论文详细描述了TcoPYK的结构特征,包括其单体的不同结构域及其在酶活性调控中的作用。研究提出了“摇摆锁定”(rock and lock)模型,解释了PYK在底物和效应物结合时的构象变化。该模型指出,PYK在结合底物后会经历一系列结构重排,最终在效应物的作用下锁定在一种高效催化构象。
结论
研究表明,单域抗体sdAb42能够识别并稳定TcoPYK的特定构象,从而抑制其活性。这一发现为开发针对锥虫类寄生虫的特异性抑制剂提供了新的思路。论文强调了抗体在药物发现中的潜力,特别是在识别和稳定动态蛋白构象方面的应用。
专业术语解释
- 单域抗体(sdAbs):一种由单个抗体结构域组成的小型抗体,具有高特异性和稳定性。
- 丙酮酸激酶(PYK):一种催化糖酵解最后一步的酶,负责将磷酸烯醇式丙酮酸转化为丙酮酸。
- 乳酸脱氢酶(LDH)偶联测定法:一种通过监测NADH吸光度变化来间接测量酶活性的方法。
- “摇摆锁定”模型:描述酶在底物和效应物结合时的构象变化过程,涉及多个结构域的旋转和稳定化。
贡献与意义
这项研究通过揭示sdAb42对TcoPYK的选择性抑制作用,展示了抗体在药物设计中的应用潜力。研究结果为开发新型抗锥虫类寄生虫药物提供了理论基础,并为进一步的结构生物学研究提供了重要的实验数据。
