PreciCE:通过数据驱动的多基因控制转录网络实现细胞命运的精密工程
原标题:PreciCE: Precision engineering of cell fates via data-driven multi-gene control of transcriptional networks
5 分
关键词
摘要
干细胞向特定细胞类型的定向分化对于再生医学和基于细胞的应用至关重要。然而,目前对细胞命运的控制方法效率低下、不够精确,并且依赖于繁琐的试错过程。为了解决这些限制,我们提出了一种基于数据驱动的多基因调控转录网络的方法。我们开发了基于dCas12a、Cas13d和dCas9的双向CRISPR工具,用于同时激活和抑制多个基因。由于多基因调控的组合复杂性巨大,我们引入了一种基于机器学习的计算算法,该算法使用单细胞RNA测序数据来预测多基因扰动集,以将起始细胞类型转化为所需的目标细胞类型。通过结合这些技术,我们建立了一个统一的工作流程,用于数据驱动的细胞命运工程,并展示了其在控制早期干细胞分化的有效性,同时通过基于逻辑的细胞命运操作抑制替代谱系。这种方法代表了在使用合成生物学工程细胞身份方面的重大进展。
AI理解论文

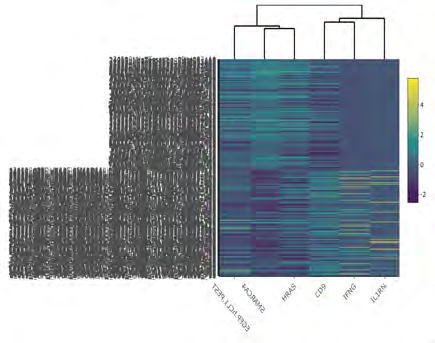
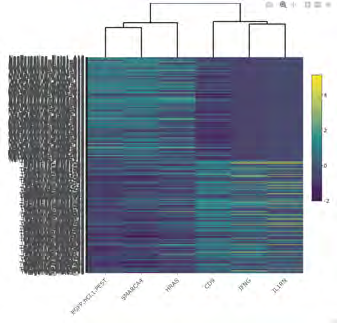
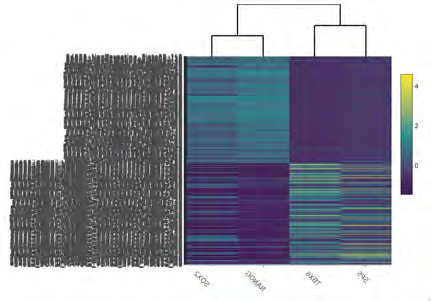



该文档主要探讨了一种双构建体CRISPR系统,用于基因调控,并通过单细胞RNA测序(scRNA-seq)分析其在**人类诱导多能干细胞(iPSCs)**中的应用。以下是该文档的主要内容:
研究背景与目的
CRISPR技术已被广泛应用于基因编辑和调控。然而,传统的CRISPR系统在多基因调控中可能导致细胞命运编程的异质性。为了解决这一问题,研究者开发了一种dCas9/dCas12a双构建体架构,旨在实现全或无的基因调控,即只有同时摄取两个构建体的细胞才能进行基因调控。
方法与实验设计
研究者将dCas12a-miniVPR-GFP和dCas9-mCherry-KRAB两个质粒共转染至iPSCs中。24小时后,约三分之一的细胞同时表达这两个构建体。通过将每个dCas蛋白的gRNA编码到另一个dCas蛋白的表达载体上,确保只有同时摄取两个构建体的细胞才能上调CD9并下调GFP。这种架构构成了一个逻辑与门(AND gate),确保只有同时摄取构建体(3)和(4)的细胞才能进行任何基因调控。
数据分析与结果
研究者使用单细胞RNA测序(scRNA-seq)对转染后的细胞进行分析。通过差异表达分析,发现目标基因在转染后48小时内发生了显著的转录变化。使用火山图和小提琴图展示了这些基因的表达变化。研究还进行了质量控制,确保数据的可靠性。
复杂术语解释
- dCas9/dCas12a:这两种蛋白是CRISPR系统中的变体,分别用于基因的抑制和激活。
- 逻辑与门(AND gate):一种逻辑电路,只有在所有输入为真时输出才为真。在此研究中,只有同时摄取两个构建体的细胞才能进行基因调控。
- 单细胞RNA测序(scRNA-seq):一种用于分析单个细胞中基因表达的技术,能够揭示细胞间的异质性。
- 火山图:一种用于展示基因表达变化的图表,横轴为表达倍数变化,纵轴为统计显著性。
贡献与意义
该研究提出了一种创新的CRISPR系统架构,能够有效减少细胞命运编程中的异质性。这一系统在基因调控和细胞分化研究中具有重要应用潜力。通过结合dCas9和dCas12a,研究者实现了更精确的基因调控,为未来的基因编辑和细胞治疗提供了新的工具。
结论
研究表明,双构建体CRISPR系统能够在细胞中实现精确的基因调控,减少不必要的异质性。这一方法不仅提高了基因调控的效率,还为未来的生物医学研究提供了新的思路和方法。
通过以上总结,读者可以全面理解该文档的内容、方法和贡献,尤其是在基因调控领域的创新应用。
