从协同进化的动态耦合图分析中得出的功能重要残基
原标题:Functionally Important Residues from Graph Analysis of Coevolved Dynamic couplings
5 分
关键词
摘要
蛋白质动态与功能之间的关系对于理解生物过程和开发有效的治疗方法至关重要。蛋白质中的功能位点对于底物结合、催化和结构变化等活动至关重要。现有的功能残基预测计算方法基于序列、结构和实验数据进行训练,但它们并未明确建模进化对蛋白质动态的影响。这一被忽视的贡献是至关重要的,因为已知进化可以通过补偿性突变微调蛋白质动态,或者提高蛋白质性能,或者在保持相同结构框架的同时使其功能多样化。为了建模这一关键贡献,我们引入了DyNoPy,这是一种结合残基共同进化分析与分子动力学(MD)模拟的计算方法,揭示功能位点之间隐藏的相关性。DyNoPy构建了一个残基-残基相互作用的图模型,识别关键残基组的社区,并根据其角色注释关键位点。通过利用共同进化的动态耦合概念——在进化过程中保留了关键动态相互作用的残基对——DyNoPy提供了一种强大的方法来预测和分析蛋白质的进化和动态。我们在与抗生素耐药性相关的染色体编码β-内酰胺酶SHV-1和PDC-3上展示了DyNoPy的有效性,突显了其为药物设计提供信息和解决紧迫医疗挑战的潜力。
AI理解论文
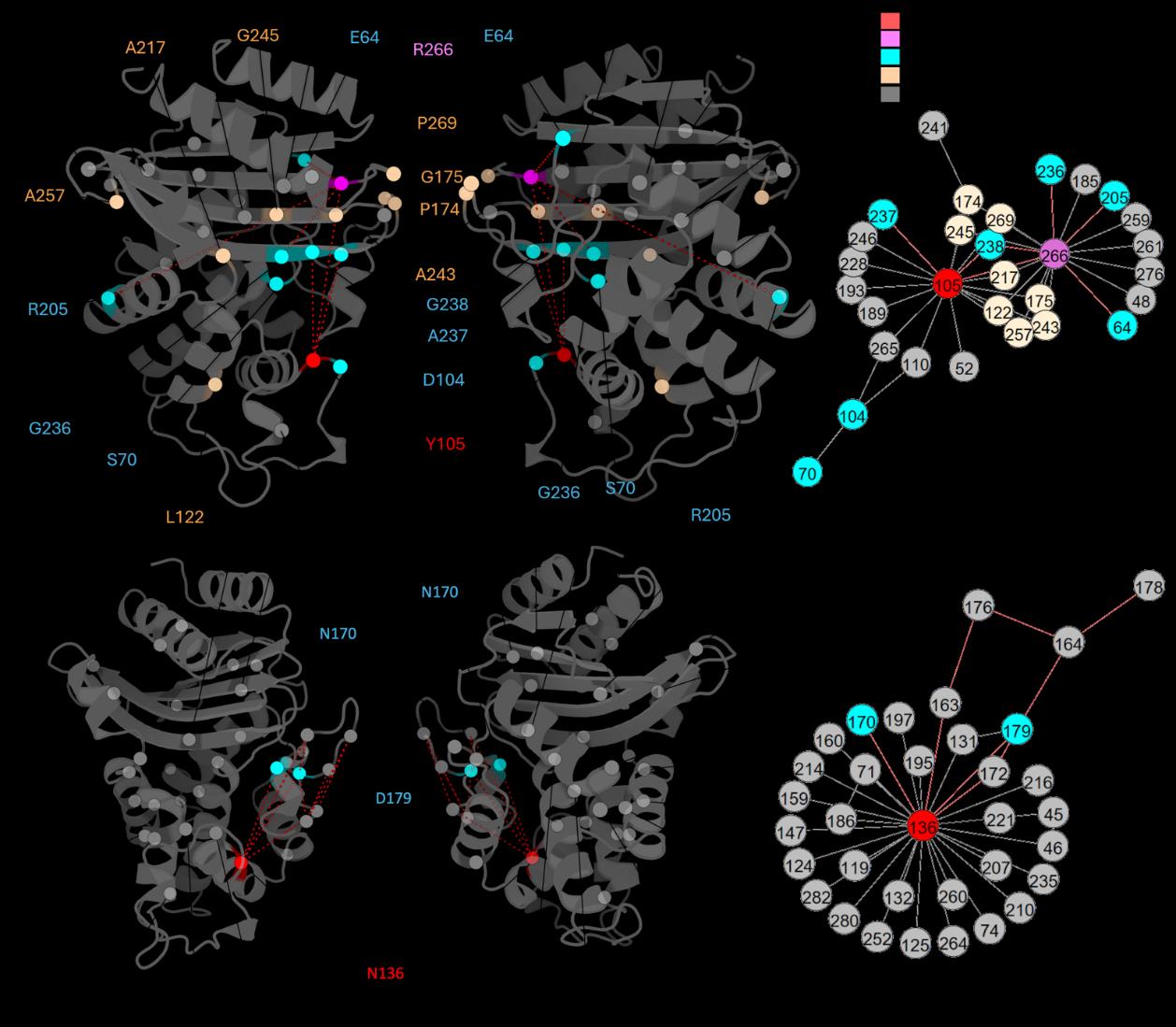


这篇论文介绍了一种名为DyNoPy的新型计算工具,用于结合残基共进化分析和分子动力学(MD)模拟,通过网络分析识别对功能动态至关重要的残基。以下是对论文的详细总结:
1. 研究背景与动机
蛋白质的功能由其结构动态性介导,突变事件可以直接影响这些动态特性。现有的计算方法主要基于序列、结构和实验数据来预测功能残基,但这些方法通常忽略了进化对蛋白质动态的影响。DyNoPy的开发旨在填补这一空白,通过结合共进化分析和MD模拟,提供对蛋白质功能动态的更全面理解。
2. 方法概述
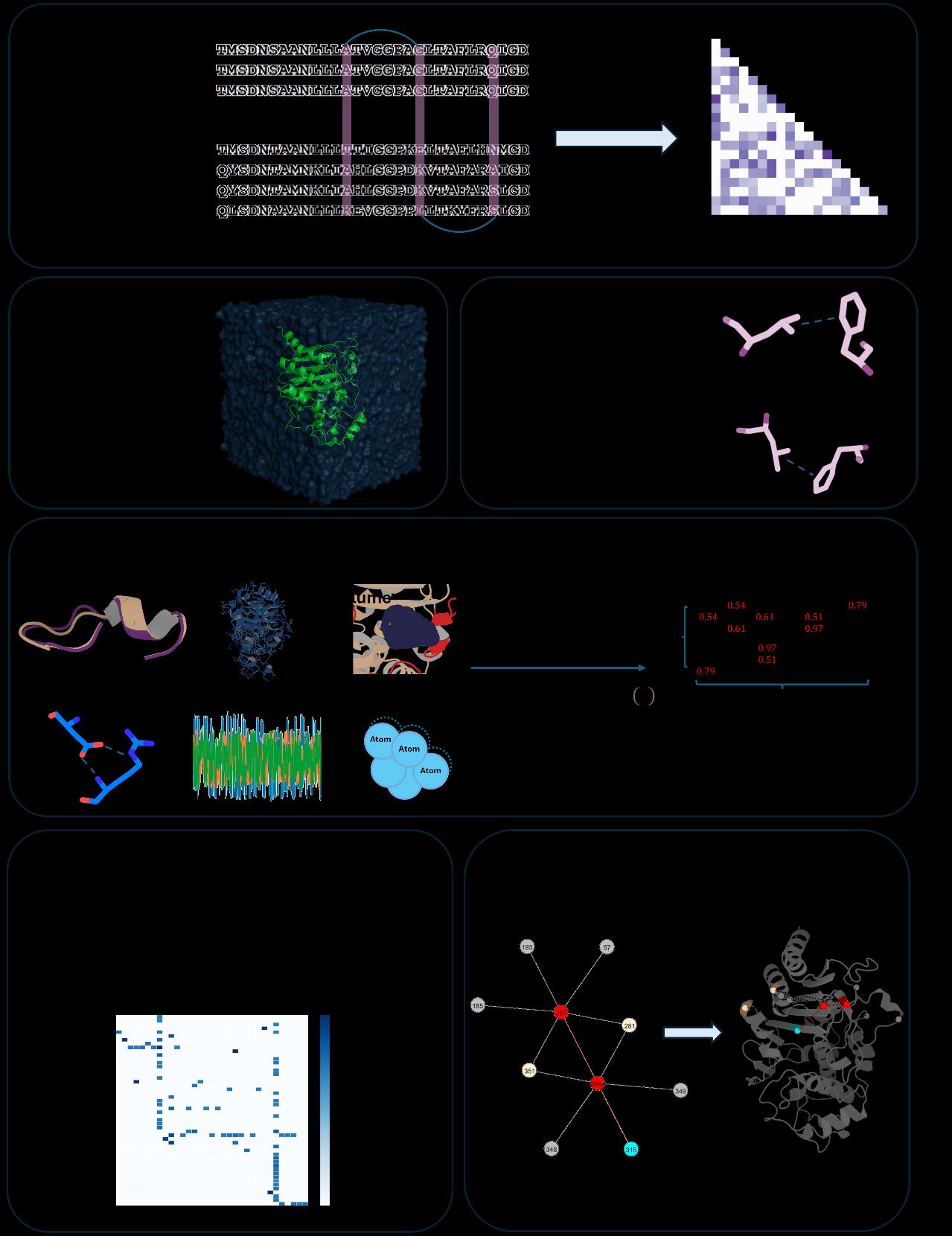
DyNoPy结合了残基共进化分析和分子动力学模拟,并通过图模型分析残基-残基相互作用。具体步骤包括:
- 共进化分析:从多序列比对(MSA)中提取残基对的共进化得分。
- 分子动力学模拟:生成蛋白质的构象集合,提供局部和全局动态信息。
- 图模型构建:将残基视为节点,残基间的动态耦合作为边,使用特征向量中心性(EVC)来评估残基的重要性。
- 社区检测:通过Girvan-Newman算法识别重要的残基群体。
3. 应用与结果
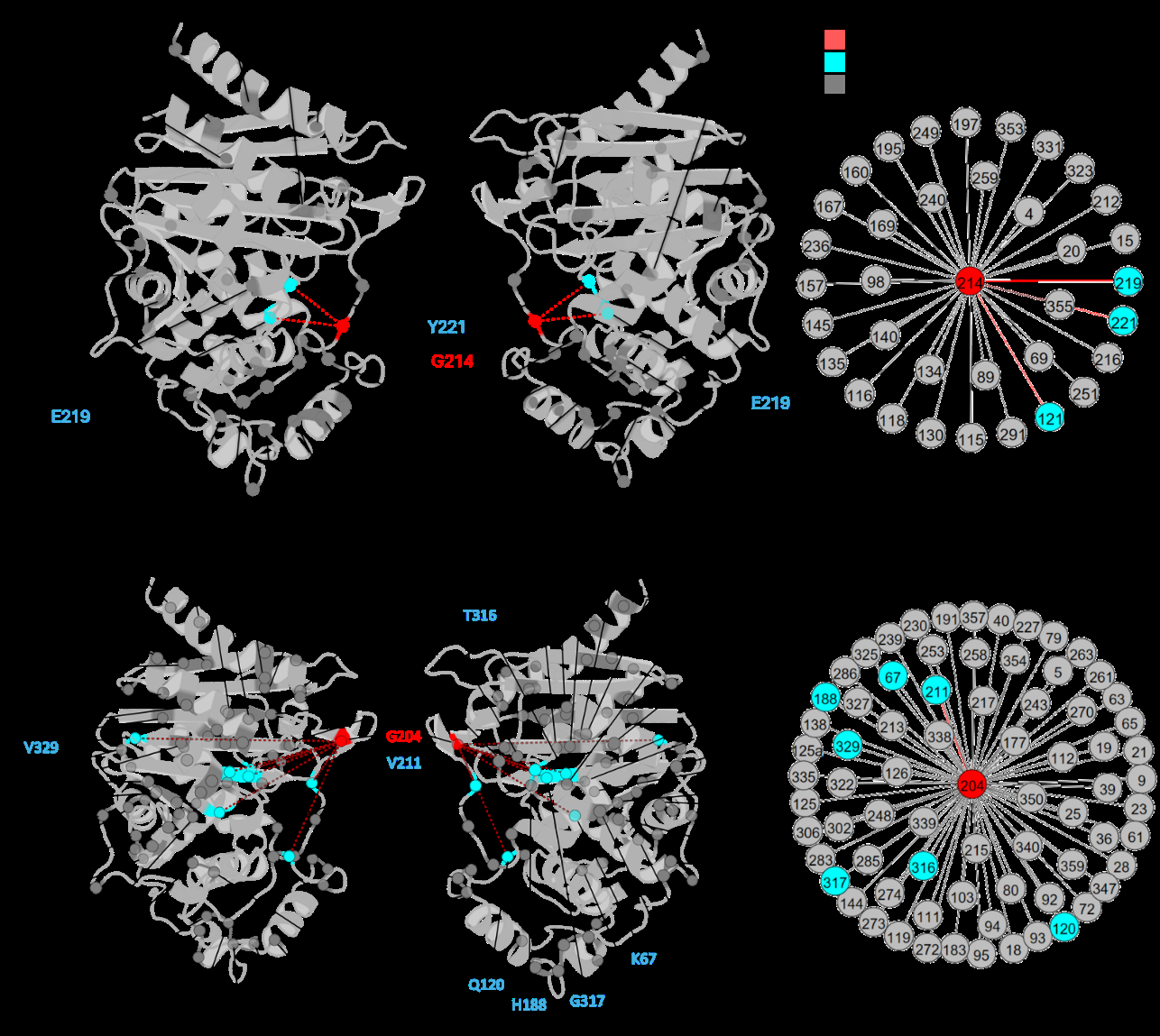
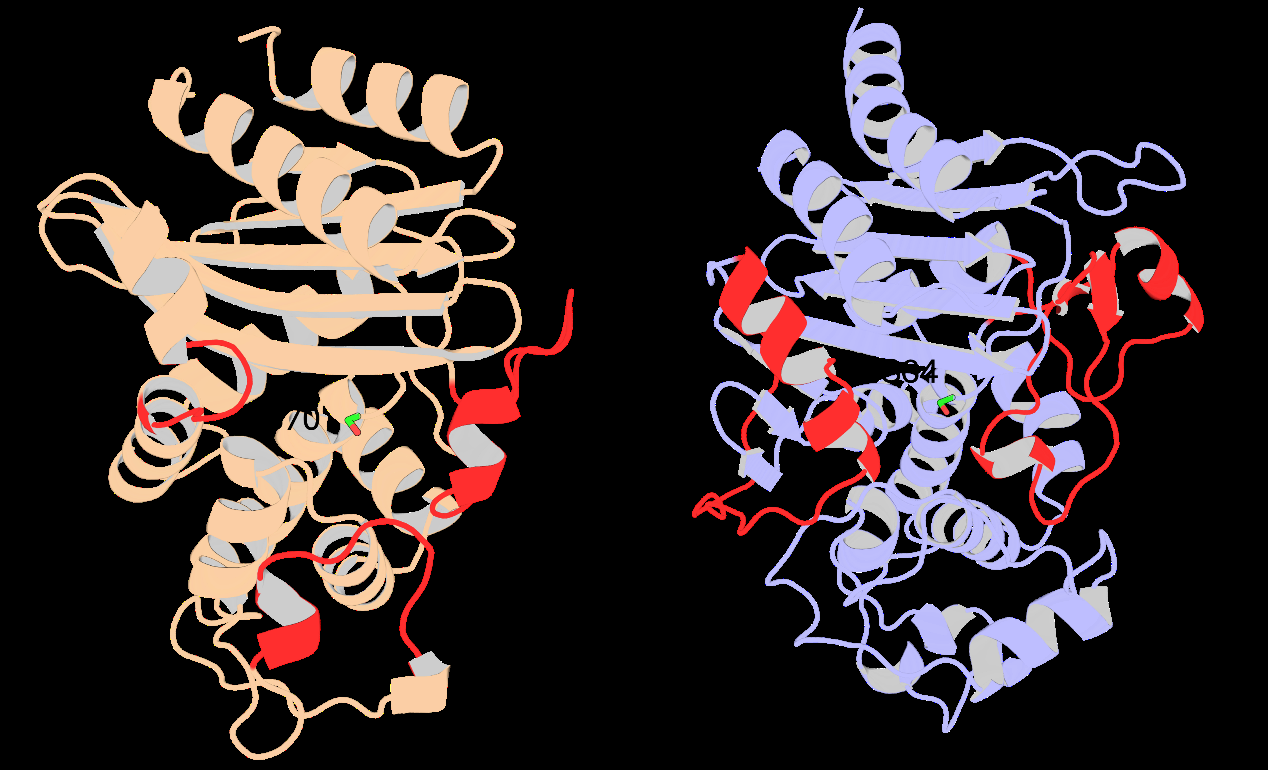
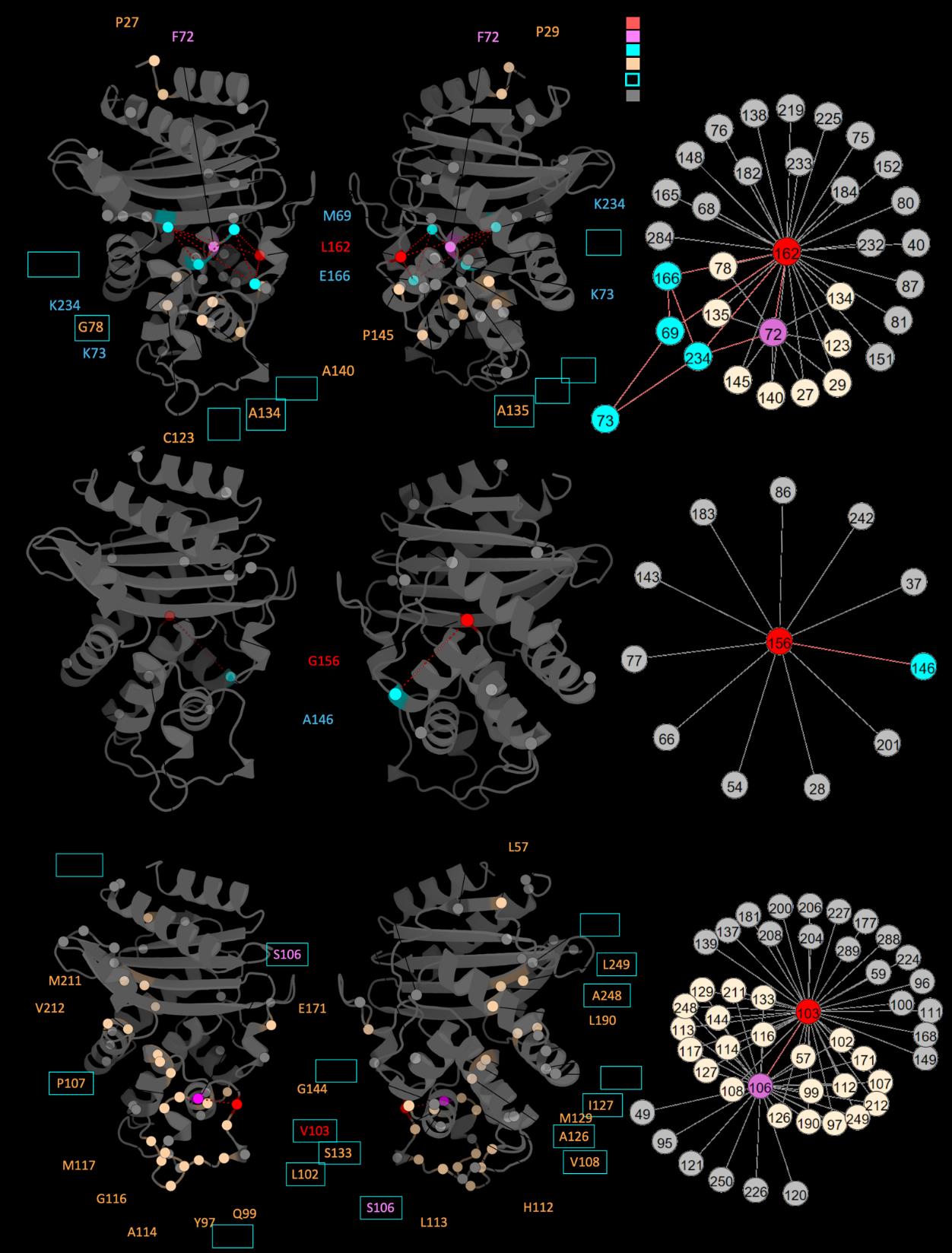
论文将DyNoPy应用于两种β-内酰胺酶:SHV-1(A类)和PDC-3(C类),以验证其有效性。
- SHV-1:作为一个实验数据丰富的系统,DyNoPy成功识别出已知功能残基,并解释了先前未探索的突变位点。
- PDC-3:尽管缺乏详细的功能注释,DyNoPy预测了可能的重要位点,为临床相关变体的研究提供了指导。
4. 技术细节
- 集体变量(CVs)选择:选择了12个不同的特征,如回转半径、**主成分分析(PCA)**的第一主成分、**时间滞后独立成分分析(TICA)**等,用于描述蛋白质的功能运动。
- 适应性采样MD模拟:使用Amber力场进行模拟,确保每个系统保留至少30,000帧的数据。
5. 贡献与意义
DyNoPy的主要贡献在于:
- 提供了一种整合进化信息和动态信息的新方法,能够识别对蛋白质功能动态至关重要的残基。
- 通过揭示这些残基及其动态相互作用的关键角色,解释了突变的致病效应,并可用于指导蛋白质功能的理性设计。
6. 结论与未来展望
论文表明,DyNoPy在识别功能动态相关残基方面具有显著潜力,尤其是在研究新型临床相关β-内酰胺酶变体时。未来的研究可以进一步扩展该方法的应用范围,并结合更多的实验数据以验证其预测能力。
通过这篇论文,研究人员展示了如何利用计算工具来深入理解蛋白质的功能动态,为药物设计和生物技术应用提供了新的视角和方法。
