装载神经递质的DNA纳米笼作为细胞和体内基于α-突触核蛋白神经病变的潜在治疗剂
原标题:Neurotransmitter loaded DNA nanocages as potential therapeutics for α-synuclein based neuropathies in cells and in vivo
5 分
关键词
摘要
帕金森病是一种以α-突触核蛋白积累为特征的神经病变,导致运动功能障碍。左旋多巴是治疗的金标准,但长期使用会导致左旋多巴诱发的运动障碍(LID)。目前迫切需要新的治疗选择来治疗基于α-突触核蛋白的神经病变。在基于α-突触核蛋白的神经病变中,除了多巴胺之外的其他神经递质的失衡作用被低估。本文探讨了血清素、肾上腺素和去甲肾上腺素作为治疗元素的作用。为了实现有效的体内递送,我们使用了以DNA纳米技术为基础的DNA四面体,其已显示出穿越生物屏障的潜力。在这项研究中,我们探索了DNA纳米装置,特别是功能化了神经递质的DNA四面体,作为一种新颖的治疗方法用于PC12细胞系统中MPTP(1-甲基-4-苯基-1,2,3,6-四氢吡啶)诱导的帕金森病。我们首先确定这些纳米装置对细胞中α-突触核蛋白清除的影响。接着研究了活性氧(ROS)、铁积累和脂质过氧化等各种细胞过程。我们还探索了加载神经递质的纳米装置在体内斑马鱼模型中的效果。结果显示,加载神经递质的DNA纳米笼可以潜在地清除细胞和体内由MPTP诱导的α-突触核蛋白聚集体。该研究的发现为将来通过功能化神经递质来利用DNA纳米技术治疗帕金森病等神经退行性疾病开辟了新途径。目录摘要:TD:NT可以通过靶向铁死亡路径清除α-突触核蛋白。
AI理解论文
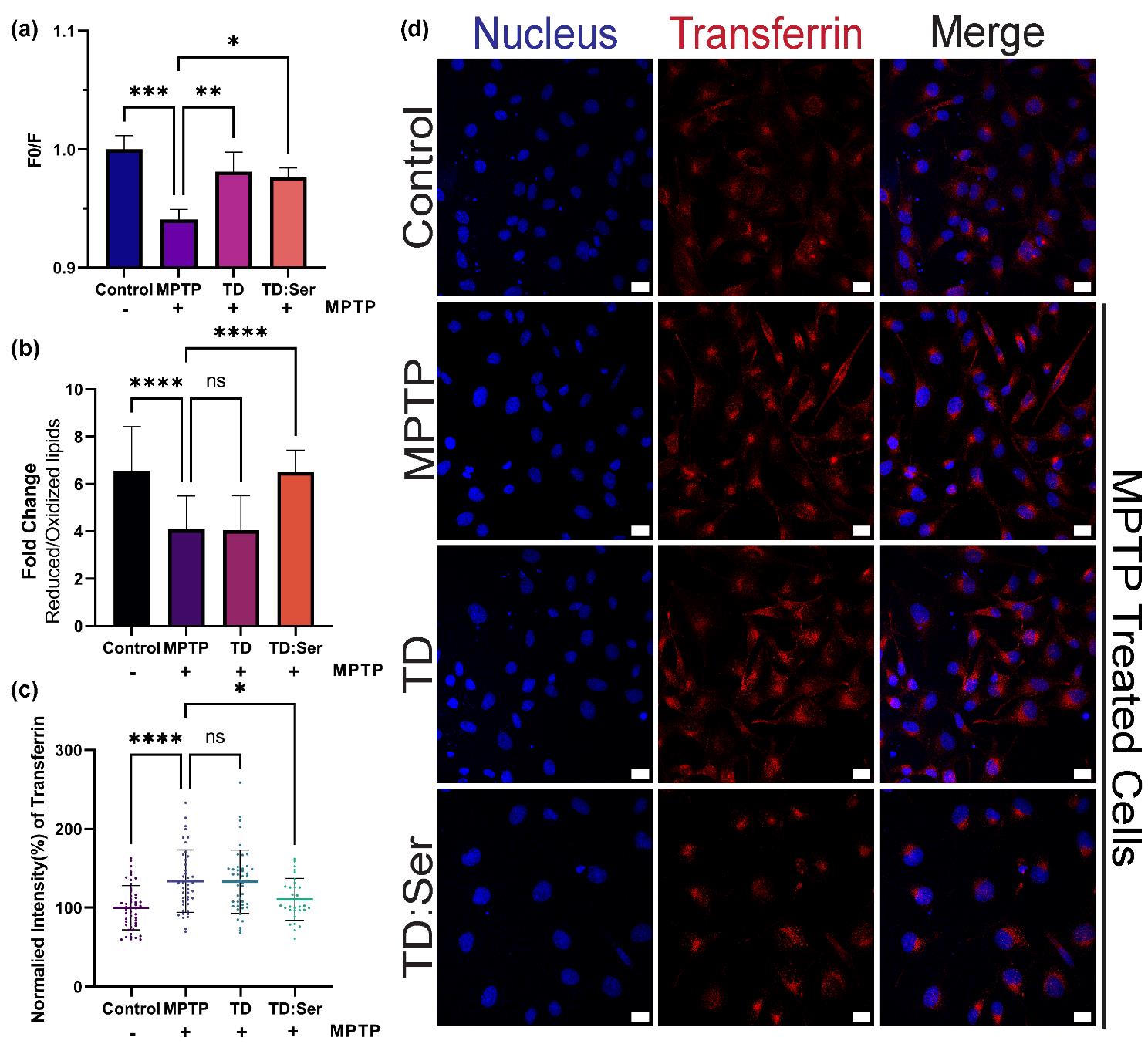


该文档主要研究了四面体框架核酸(TD)及其与神经递质结合后的系统(TD:NT)在帕金森病(PD)中的应用。研究的重点在于探索这些纳米结构在细胞和体内模型中的神经保护和神经治疗效果,并评估其在减少活性氧(ROS)和脂质过氧化方面的潜力。
研究背景与目的
帕金森病是一种常见的神经退行性疾病,其特征是多巴胺能神经元的丧失和α-突触核蛋白的异常聚集。活性氧的过量产生被认为是导致神经元损伤的关键因素之一。本文旨在通过合成和应用TD及其与神经递质结合的系统,探讨其在减少ROS和脂质过氧化方面的效果,从而为帕金森病的治疗提供新的思路。
材料与方法
-
材料:研究中使用的主要材料包括从Sigma Aldrich获得的引物、MPTP盐酸盐、DCFDA、DAPI等,以及从ATCC获得的PC12细胞。
-
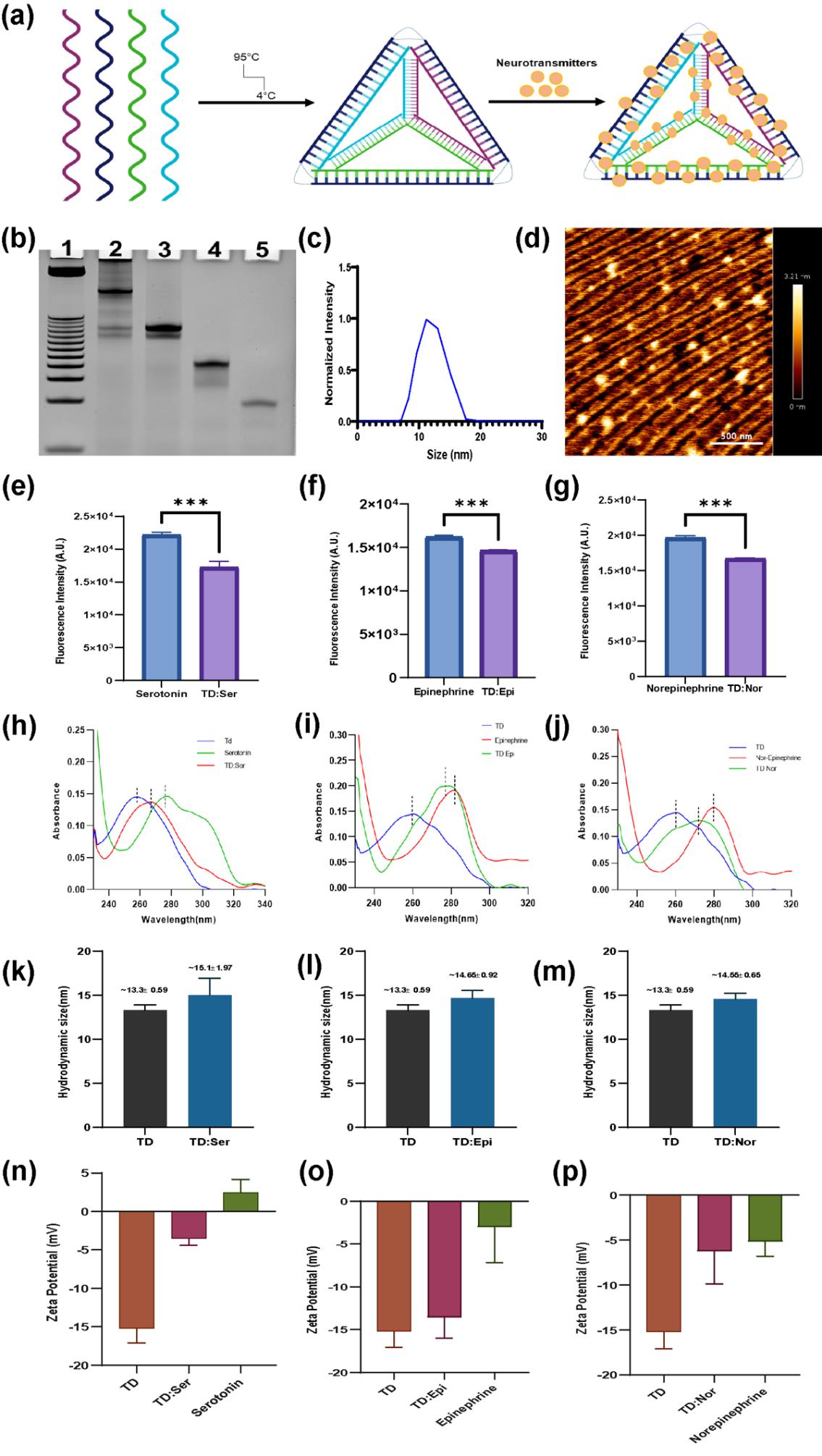
TD的合成:TD通过四条单链寡核苷酸的退火过程合成,最终浓度为2.5 µM,储存于4°C。
-
TD:NT系统的合成:TD与血清素、肾上腺素和去甲肾上腺素按1:50、1:500和1:500的比例结合,室温下避光孵育15分钟。
-
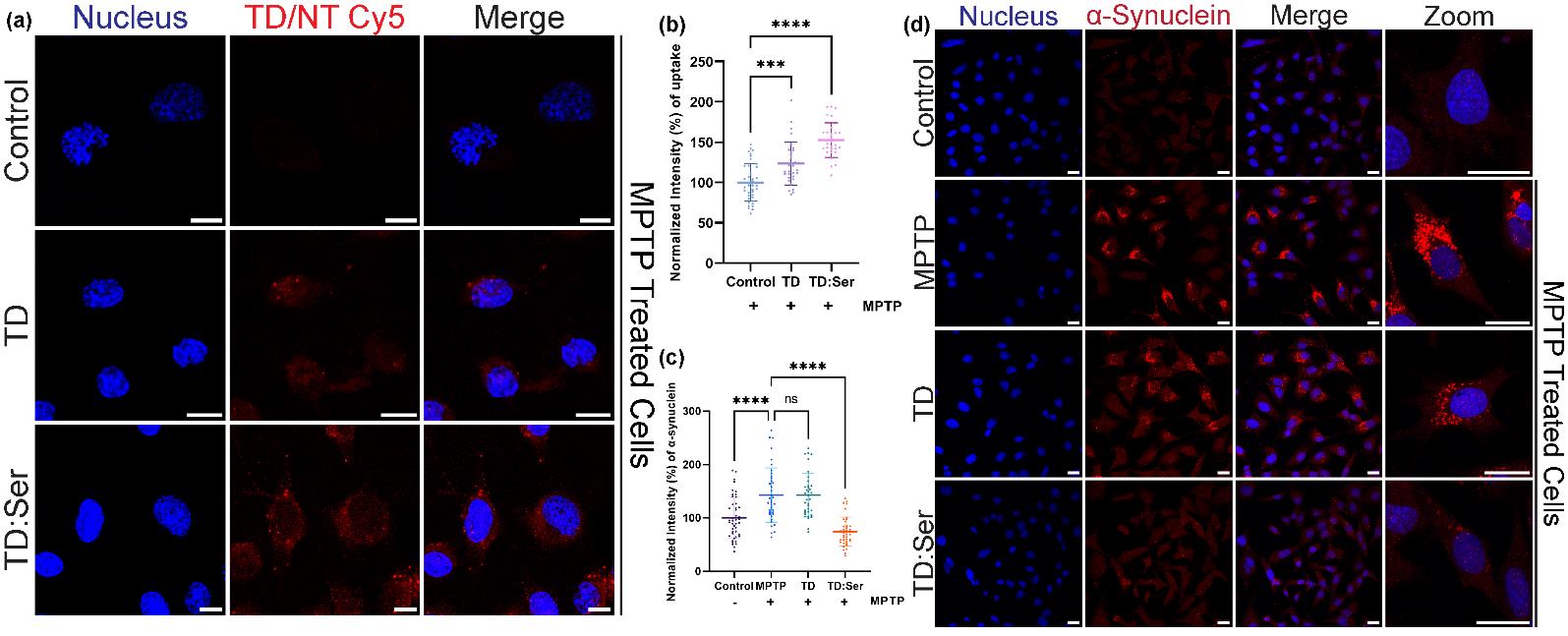
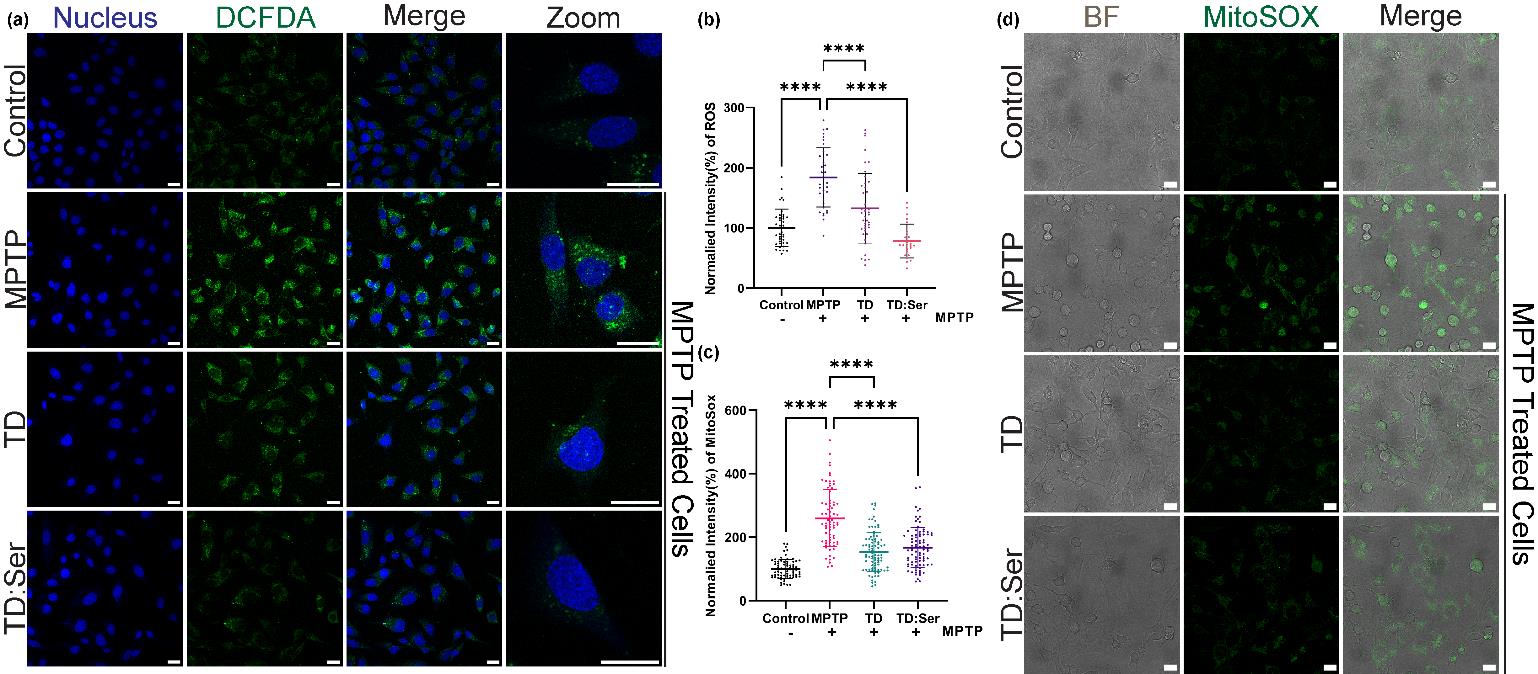
细胞实验:PC12细胞在F12K培养基中培养,进行MPTP处理后,给予TD:NT处理。细胞摄取、α-突触核蛋白免疫染色、DCFDA和线粒体超氧化物指示剂等多种实验用于评估TD:NT的效果。
-
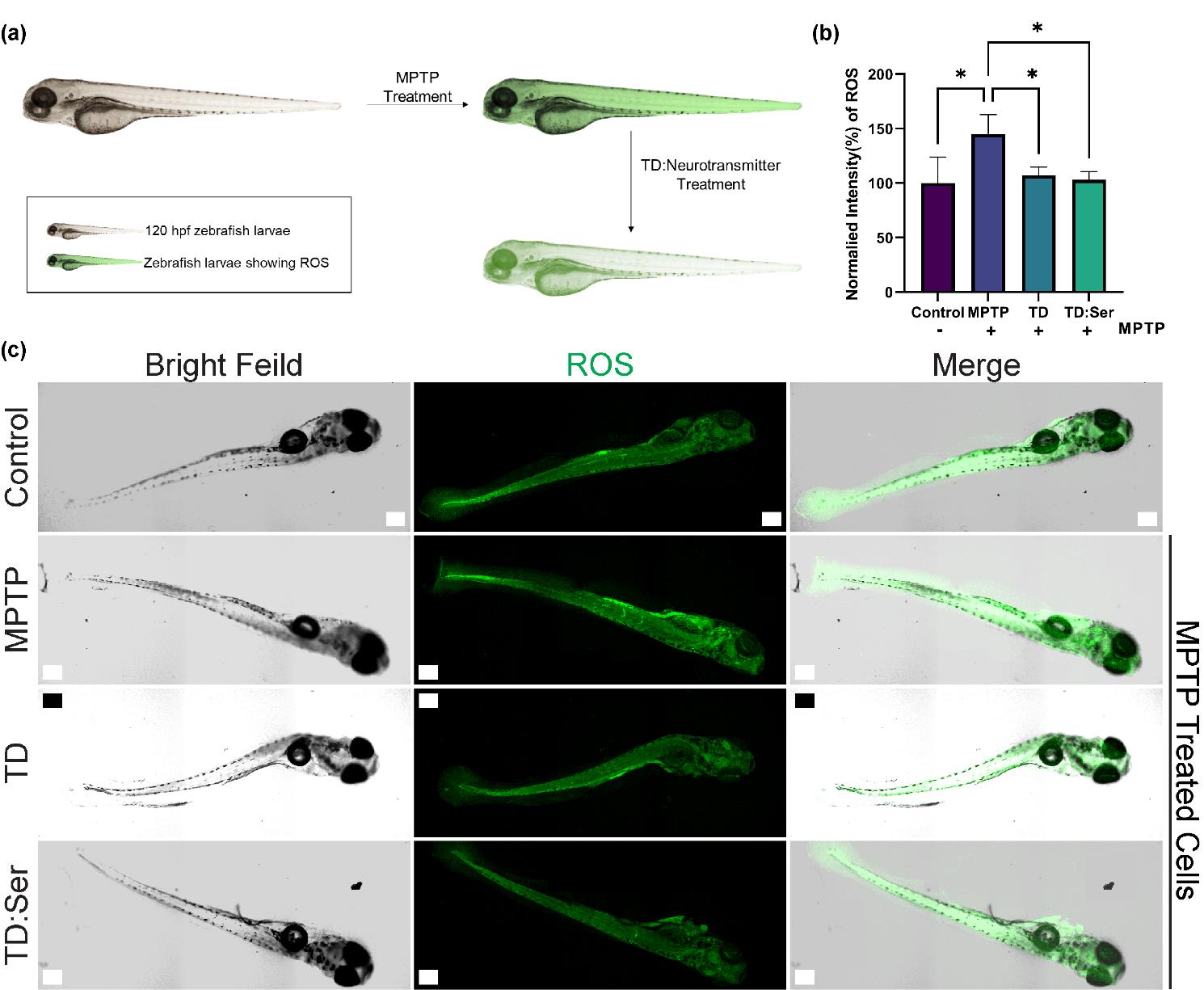
体内实验:使用Assam野生型斑马鱼幼虫进行ROS测定,评估TD:NT在体内模型中的效果。
结果与讨论
-
细胞摄取与免疫染色:TD:NT能够有效进入细胞,并显著减少α-突触核蛋白的聚集。
-
ROS和脂质过氧化:DCFDA和线粒体超氧化物指示剂实验显示,TD:NT显著降低了细胞内的ROS水平。脂质过氧化实验进一步证实了TD:NT在减少氧化应激方面的潜力。
-
体内模型验证:在斑马鱼模型中,TD:Ser和TD:Nor表现出显著的ROS减少效果,表明其在体内的神经保护潜力。
统计分析
所有实验均以三次重复进行,数据以平均值±标准差表示。使用GraphPad Prism 9.0进行单因素方差分析(ANOVA)和Tukey校正,显著性水平用p值表示。
结论
研究表明,TD:Ser和TD:Nor在减少ROS和脂质过氧化方面具有显著效果,并在细胞和体内模型中展示了良好的神经保护潜力。这些结果为帕金森病的治疗提供了新的研究方向和潜在的治疗策略。
贡献与展望
本文通过创新性地将四面体框架核酸与神经递质结合,探索了其在神经退行性疾病中的应用潜力。未来的研究可以进一步优化这些纳米结构的设计,并在更复杂的动物模型中验证其疗效。
专业术语解释
- 四面体框架核酸(TD):一种由寡核苷酸自组装形成的纳米结构,具有良好的生物相容性和稳定性。
- 活性氧(ROS):细胞代谢过程中产生的氧化性分子,过量的ROS会导致细胞损伤。
- 脂质过氧化:脂质分子受到氧化应激的影响而发生的化学变化,常用于评估细胞的氧化损伤程度。
通过本研究,TD及其与神经递质结合的系统展示了在帕金森病治疗中的潜力,为未来的研究和临床应用奠定了基础。
