非经典端粒酶逆转录酶通过STAT5控制主动脉瓣细胞的成骨重编程
原标题:Non-canonical Telomerase Reverse Transcriptase Controls Osteogenic Reprogramming of Aortic Valve Cells Through STAT5
5 分
关键词
摘要
背景 钙化性主动脉瓣疾病(CAVD)是瓣膜小叶的病理性重塑。瓣膜小叶成骨重编程的初始步骤尚未完全了解。由于端粒酶逆转录酶(TERT)过表达使间充质干细胞分化为成骨细胞,我们研究了TERT是否有助于瓣膜间质细胞(VICs)的成骨重编程。方法 使用人类对照和CAVD主动脉瓣小叶以及患者特异性hVICs进行体内和体外钙化实验。hVICs和从Tert-/-和Terc-/-小鼠中分离的细胞的功能丧失实验用于机制研究。在Tert+/+和Tert-/-小鼠中体外和体内评估钙化。通过计算机建模、邻近连接和共免疫沉淀实验定义新的TERT相互作用伙伴。染色质免疫沉淀和CUT&TAG测序定义蛋白质-DNA相互作用。结果 TERT蛋白在钙化的瓣膜小叶中高度表达,而端粒长度、DNA损伤或衰老标志物没有变化,这些特征在分离的原代hVICs中得以保留。TERT表达在成骨或炎症刺激下增加,敲低或基因删除TERT可防止体外和体内钙化。在机制上,TERT通过NF-κB上调并需要启动成骨重编程,与其经典的逆转录酶活性和lncRNA TERC无关。TERT通过与信号转导和转录激活因子5(STAT5)结合发挥非经典的成骨功能。STAT5的耗竭或抑制可防止钙化。发现STAT5结合于成骨重编程的主调控因子Runt相关转录因子2(RUNX2)的启动子区域。最后,我们证明与对照组织相比,TERT和STAT5在CAVD组织中上调并共定位。结论 TERT的非经典活性是启动钙化所必需的。TERT通过炎症信号通路上调,并与STAT5合作结合RUNX2基因启动子。这些数据识别出一种新的机制和潜在的治疗靶点,以减少血管钙化。新颖性和意义 已知什么?钙化性主动脉瓣疾病(CAVD)是最常见的主动脉瓣病理形式。CAVD与年龄密切相关,导致心力衰竭和中风的高风险。目前,唯一的治疗选择是瓣膜置换,这带来了显著的医疗成本和对患者的额外风险。Runt相关转录因子2(RUNX2)是干细胞分化为成骨细胞和心血管细胞成骨重编程所需的主转录因子。然而,驱动其在主动脉瓣细胞中活性的早期事件定义不清。除了其逆转录酶酶活性外,TERT表现出非经典的转录调控功能,TERT的过表达使间充质干细胞趋向成骨细胞谱系分化。本文贡献了哪些新信息?钙化的主动脉小叶和瓣膜间质细胞中的TERT蛋白水平及其非经典的成骨活性与端粒长度和细胞衰老的变化无关。TERT的基因丧失或耗竭可防止瓣膜间质细胞、冠状动脉平滑肌细胞和间充质干细胞体外及血管体内的钙化。在成骨重编程的早期,炎症信号促进TERT与SMARCA4和STAT5共定位,并且这种TERT连接的STAT5结合于成骨转录程序的主调控因子RUNX2基因启动子。STAT5的耗竭和药理学抑制可防止人类瓣膜间质细胞、冠状动脉平滑肌细胞和间充质干细胞的钙化。临床意义是什么?我们已识别出TERT-STAT5作为一种新的信号轴,协调主动脉瓣细胞成骨重编程的早期步骤。抑制TERT/STAT5相互作用或其活性可用于开发治疗策略,以阻止或预防主动脉瓣、生物假体瓣膜及其他心血管组织的钙化。目前,侵入性和昂贵的外科手术是CAVD患者的唯一治疗选择。发现和定义驱动血管钙化的早期事件识别出新的和可药物化的靶点,用于开发非手术治疗。
AI理解论文

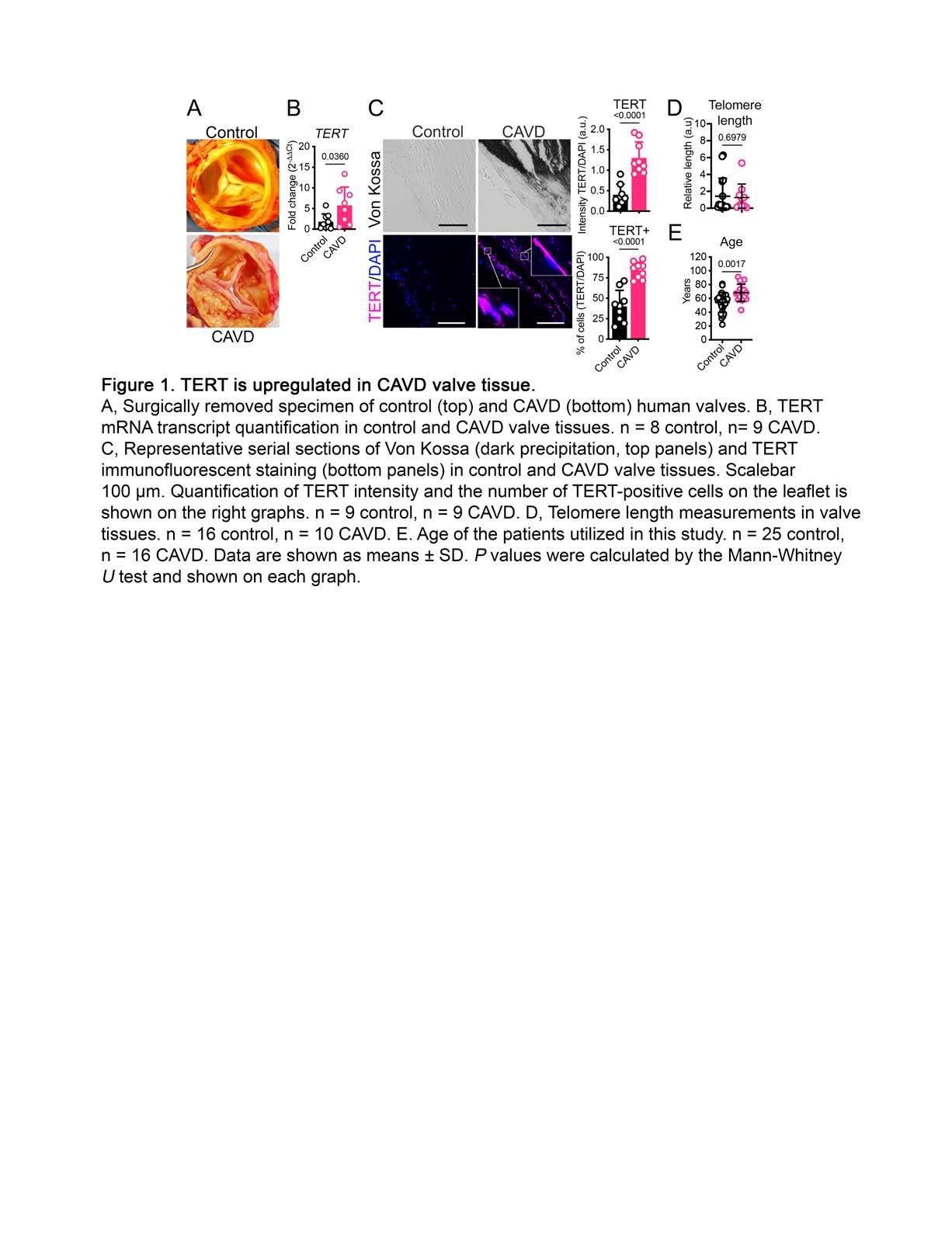
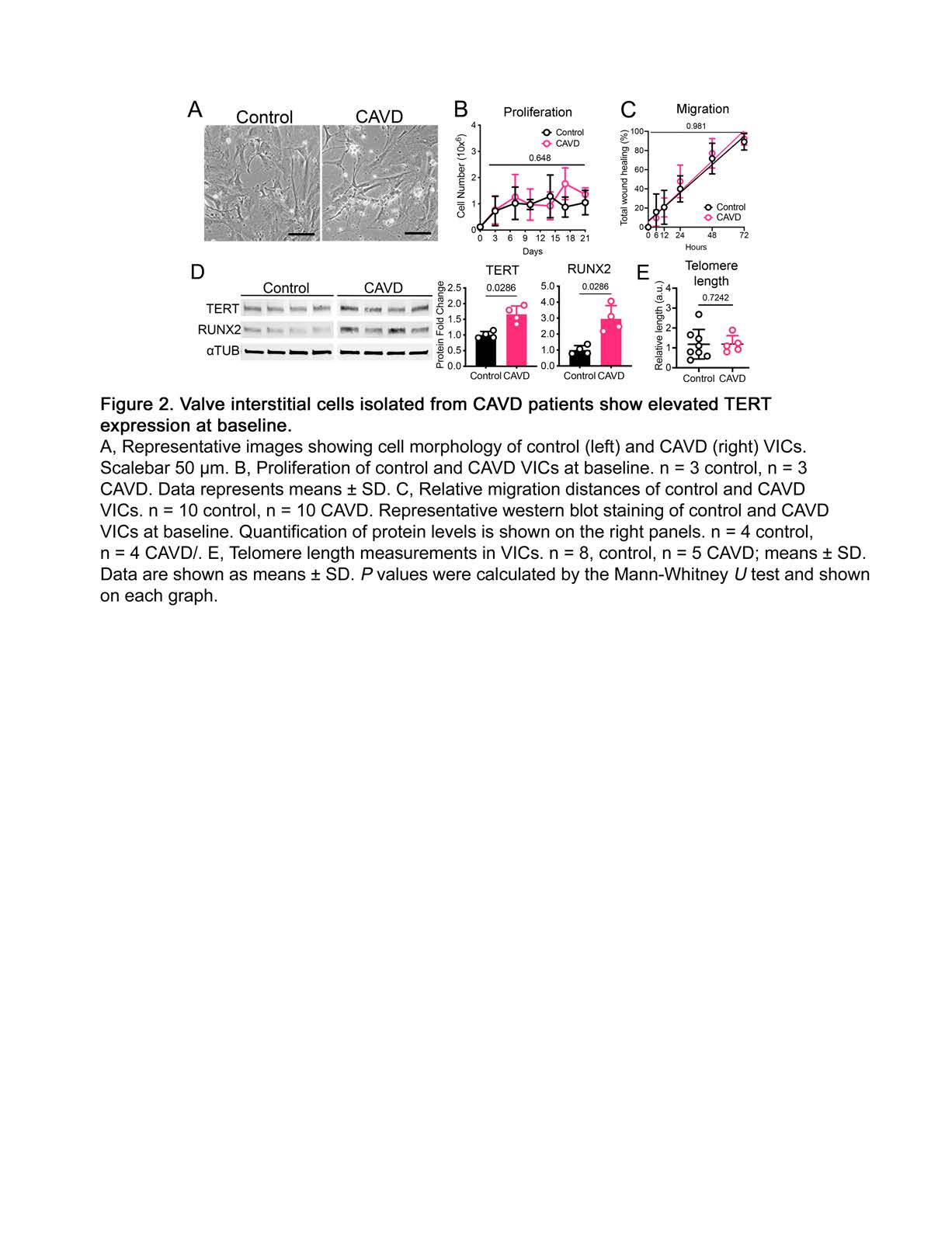
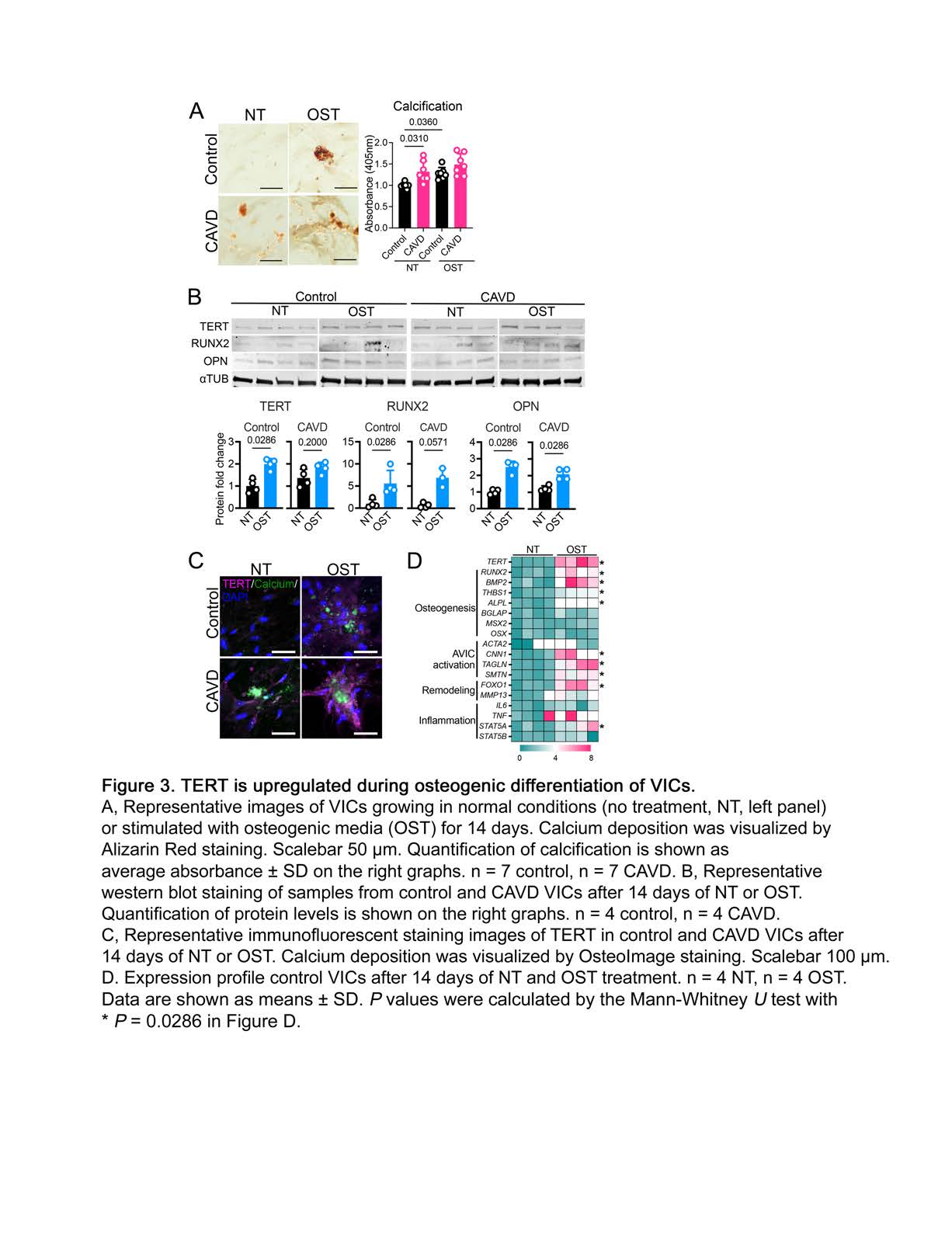
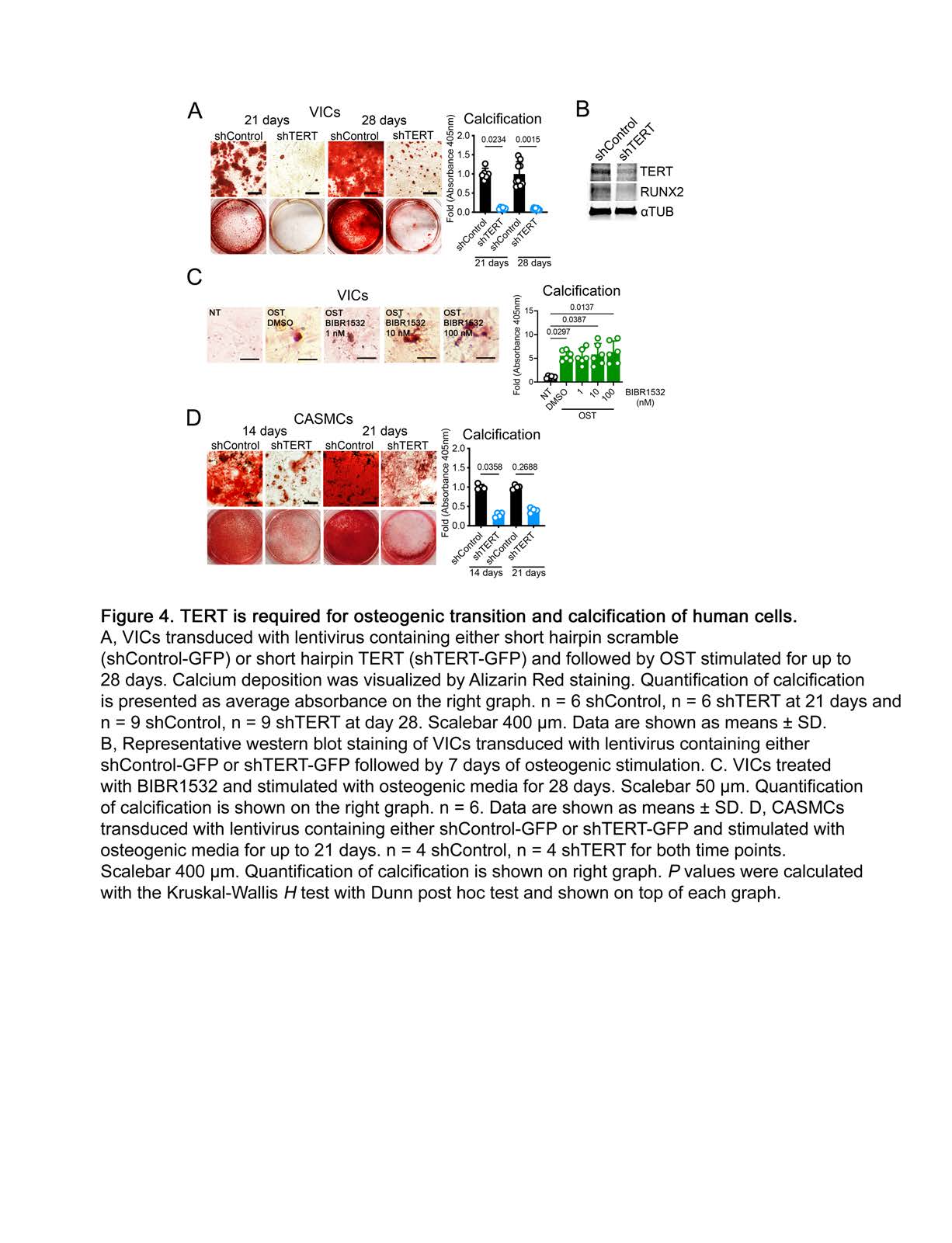


该文档主要研究了端粒酶逆转录酶(TERT)和信号转导及转录激活因子5(STAT5)在主动脉瓣钙化性心脏病(CAVD)中的作用机制。研究揭示了TERT和STAT5如何通过调控RUNX2基因的表达,促进**瓣膜间质细胞(VICs)**的成骨重编程,从而加速CAVD的病理进程。
研究背景
CAVD是一种常见的心血管疾病,其特征是主动脉瓣的钙化和硬化,最终导致瓣膜功能障碍。尽管其病理机制尚不完全清楚,但炎症和成骨重编程被认为是关键因素。TERT作为端粒酶的催化亚基,通常与细胞增殖和衰老相关,而STAT5是一种转录因子,参与多种细胞信号通路的调控。
研究方法
研究采用了多种实验技术,包括免疫荧光染色、染色质免疫沉淀(ChIP)、定量PCR(qPCR)以及Von Kossa染色等,以分析TERT和STAT5在CAVD中的表达和相互作用。研究对象包括从人类主动脉瓣中分离的VICs,以及通过手术或尸体捐赠获得的人类组织样本。
关键发现
-
TERT和STAT5的上调和共定位:研究发现,在CAVD组织中,TERT和STAT5的表达显著上调,并且两者在细胞核中共定位。这表明它们可能形成复合物,共同参与基因调控。
-
TERT/STAT5复合物促进RUNX2表达:通过ChIP-qPCR分析,研究证实TERT和STAT5能够结合到RUNX2基因的启动子区域,促进其表达。RUNX2是一个关键的成骨转录因子,其上调与VICs的成骨重编程密切相关。
-
抑制STAT5减少钙化:使用STAT5抑制剂处理VICs,显著减少了在成骨刺激条件下的钙化。这进一步支持了STAT5在CAVD病理过程中的重要作用。
研究贡献
该研究首次揭示了TERT和STAT5在CAVD中的协同作用,提供了一个新的分子机制,即TERT通过促进STAT5的基因调控功能,推动VICs的成骨重编程。这一发现不仅深化了对CAVD病理机制的理解,还为潜在的治疗策略提供了新的靶点。
专业术语解释
- 端粒酶逆转录酶(TERT):一种酶,负责维持端粒的长度,通常与细胞增殖和衰老相关。
- 信号转导及转录激活因子5(STAT5):一种转录因子,参与细胞生长、分化和存活的信号传导。
- 染色质免疫沉淀(ChIP):一种用于研究蛋白质与DNA相互作用的技术。
- 定量PCR(qPCR):一种用于定量分析基因表达的分子生物学技术。
- Von Kossa染色:一种用于检测组织中钙化的染色方法。
结论
该研究通过揭示TERT和STAT5在CAVD中的作用机制,为理解CAVD的病理过程提供了新的视角,并为未来的治疗策略开发提供了潜在的分子靶点。研究结果强调了TERT和STAT5在炎症和成骨重编程中的关键角色,提示它们可能是CAVD治疗的有效靶点。
